题目内容
【题目】冶金工业、硝酸工业的废气废液中含氮化合物污染严重,必须处理达标后才能排放。
Ⅰ.用活性炭处理工厂尾气中的氮氧化物。
(1)已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1=a kJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=b kJ·mol-1
③C(s)+O2(g)=CO2(g) ΔH3=c kJ·mol-1
则反应C(s)+2NO(g) ![]() N2(g)+CO2(g)的ΔH=_____。
N2(g)+CO2(g)的ΔH=_____。
(2)在容积不变的密闭容器中,一定量的NO与足量的C发生反应:C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是______。
N2(g)+CO2(g) ΔH=Q kJ·mol-1,平衡时c(NO)与温度T的关系如图1所示,下列说法正确的是______。

A.其他条件不变,改变活性炭的用量,平衡一定不移动
B.该反应的Q>0,所以T1、T2、T3对应的平衡常数:K1<K2<K2
C.温度为T2时,若反应体系处于状态D,则此时v正>v逆
D.若状态B、C、D体系的压强分别为p(B)、p(C)、p(D),则p(D)=p(C)>p(B)
(3)已知某温度时,反应C(s)+2NO(g) ![]() N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_______
N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,t1时刻达到平衡,请在图2中画出反应过程中c(NO)随时间t的变化曲线。_______
(4)工业上实际处理废气时,常用活性炭作催化剂,用NH3还原NO,同时通入一定量的O2以提高处理效果。当n(NH3)=n(NO)时,写出体系中总反应的化学方程式:______________。
Ⅱ.用纳米铁粉或电解法处理废水中的硝酸盐。
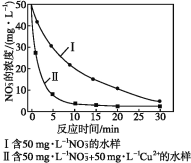
(5)纳米铁粉处理污水中NO3-的离子方程式为4Fe+ NO3-+10H+=4Fe2++NH4++3H2O。
实验证实,pH偏小将会导致NO3-的去除率下降,其原因是_______________。相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异(见图),产生该差异的可能原因是__。
(6)电解法处理水中硝酸盐的原理是以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解。请写出阴极的电极反应式:__________。
【答案】(![]() +c)kJ·mol-1 C
+c)kJ·mol-1 C 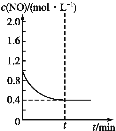 4NH3+4NO+O2
4NH3+4NO+O2![]() 4N2+6H2O 纳米铁粉与H+反应生成H2,导致NO3-的去除率下降 Cu或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成的Fe-Cu原电池增大了纳米铁粉去除NO3-的反应速率) 2 NO3-+12H++10e-=N2↑+6H2O(或10H++NO3-+8e-=NH4++3H2O)
4N2+6H2O 纳米铁粉与H+反应生成H2,导致NO3-的去除率下降 Cu或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成的Fe-Cu原电池增大了纳米铁粉去除NO3-的反应速率) 2 NO3-+12H++10e-=N2↑+6H2O(或10H++NO3-+8e-=NH4++3H2O)
【解析】
(1)根据盖斯定律分析解答;
(2)由图可知,温度越高平衡时c(NO)越大,即升高温度平衡逆向移动,说明该反应的正反应为放热反应,△H<0,据此分析判断;
(3) 根据三段式结合平衡常数计算出平衡时c(NO),再画出图像;
(4)根据题意,用活性炭作催化剂,反应物为NH3、NO和O2且n(NH3)=n(NO)生成氮气和水;
(5) pH偏小时,纳米铁粉能够与H+反应;根据图像,从Cu2+的存在思考对反应速率的影响;
(6)阴极上NO3-放电生成氮气(也可能生成铵根离子等),据此书写电极反应式。
(1)①4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH1=a kJ·mol-1,②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=b kJ·mol-1,③C(s)+O2(g)=CO2(g) ΔH3=c kJ·mol-1,根据盖斯定律,将方程式按照![]() +③得:C(s) +2NO(g)
+③得:C(s) +2NO(g) ![]() N2(g) +CO2(g) ΔH=(
N2(g) +CO2(g) ΔH=(![]() +c)kJ·mol-1,故答案为:(
+c)kJ·mol-1,故答案为:(![]() +c)kJ·mol-1;
+c)kJ·mol-1;
(2)由图可知,温度越高平衡时c(NO)越大,即升高温度平衡逆向移动,说明该反应的正反应为放热反应,△H<0。
A.其他条件不变,改变活性炭的用量,炭为固体,因此平衡一定不移动,但是如果将炭完全移除,过加入足够多的炭,影响了容器中气体的压强,则平衡会发生移动,故A错误;B. 该反应正反应是放热反应,Q<0,升高温度平衡向逆反应方向移动,所以升高温度,化学平衡常数减小,所以T1、T2、T3对应的平衡常数K1>K2>K2,故B错误;C. T2时反应进行到状态D,c(NO)高于平衡浓度,故反应向正反应方向进行,则一定有υ(正)>υ(逆),故C正确;D. 达到平衡状态时,压强和温度成正比例关系,则PB=PD<PC,故D错误;故选C;
(3) 某温度时,反应C(s)+2NO(g) ![]() N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,随着反应的进行,c(NO)由1mol/L逐渐减小,设c(NO)的变化量为2x,
N2(g)+CO2(g)的平衡常数K=9/16,在该温度下的2 L密闭容器中投入足量的活性炭和2.0 mol NO发生反应,随着反应的进行,c(NO)由1mol/L逐渐减小,设c(NO)的变化量为2x,
C(s)+2NO(g) ![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始(mol/L) 1 0 0
反应(mol/L) 2x x x
平衡(mol/L) 1-2x x x
则![]() =
=![]() ,解得x=0.3,则平衡时,c(NO)=0.4mol/L,因此c(NO)随时间t的变化曲线为
,解得x=0.3,则平衡时,c(NO)=0.4mol/L,因此c(NO)随时间t的变化曲线为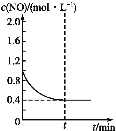 ,故答案为:
,故答案为: ;
;
(4)用活性炭作催化剂,用NH3还原NO,同时通入一定量的O2以提高处理效果。当n(NH3)=n(NO)时,反应的化学方程式为4NH3+4NO+O2![]() 4N2+6H2O,故答案为:4NH3+4NO+O2
4N2+6H2O,故答案为:4NH3+4NO+O2 ![]() 4N2+6H2O;
4N2+6H2O;
(5)纳米铁粉处理污水中NO3-的离子方程式为4Fe+ NO3-+10H+=4Fe2++NH4++3H2O,pH偏小时,纳米铁粉与H+反应生成H2,导致NO3-的去除率下降;根据图像,相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异,可能原因是Cu或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成的Fe-Cu原电池增大了纳米铁粉去除NO3-的反应速率),故答案为:纳米铁粉与H+反应生成H2,导致NO3-的去除率下降;Cu或Cu2+对纳米铁粉去除NO3-的反应有催化作用(或形成的Fe-Cu原电池增大了纳米铁粉去除NO3-的反应速率);
(6)以金属Pt作电极,用质子交换膜把溶液分为阴阳两极区,阴极区为含硝酸盐的工业废水,接通直流电源进行电解,阴极上NO3-放电生成氮气(也可能生成铵根离子等),电极反应式为2 NO3-+12H++10e-=N2↑+6H2O,故答案为:2 NO3-+12H++10e-=N2↑+6H2O。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】已知钠与氧气在不同条件下会发生不同的反应。
(1)将金属钠长时间放置于空气中可发生如下一系列变化,写出此变化中①③步转化的化学方程式:
Na![]() Na2O
Na2O![]() NaOH
NaOH![]() Na2CO3·10H2O→Na2CO3
Na2CO3·10H2O→Na2CO3
①___________;
③__________。
(2)将钠置于坩埚内,在空气中加热,可燃烧生成一种淡黄色物质。
①钠在空气中燃烧的化学方程式为___________。
②某学习小组通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有4.0gNa2O2的烧杯中加入50mL蒸馏水 | 剧烈反应,产生能使带火星木条复燃的气体,得到的无色溶液a |
向溶液a中滴入两滴酚酞 | ⅰ.溶液变红 ⅱ.10分种后溶液颜色明显变浅,稍后,溶液变为无色 |
Na2O2与水反应的离子方程式是___________,甲同学认为过氧化钠中阴离子结合水中氢离子生成了H2O2,溶液a中的H2O2将酚酞氧化导致褪色。用实验证实H2O2的存在:取少量溶液a,加入试剂___________(填化学式),有气体产生。
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是_____(填元素符号);⑩元素符号为_____;
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐 M,M 中含有的化学键类型有_____;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_____。
(4)③、⑤、⑦、⑧所形成的离子,其半径由小到大的顺序是_____(填离子符号)。
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____(填物质化学式);呈两性的氢氧化物是_____(填物质化学式),该化合物与NaOH 溶液反应的离子方程式为_________。
(6)用电子式表示元素③与⑨形成化合物的过程_____。




