题目内容
【题目】煤的液化可以合成甲醇。下列有关说法正确的是
①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1
②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ·mol—1
③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g)△H3=akJ·mol
O2(g)△H3=akJ·mol
A. 催化液化I的反应在高温下更容易自发进行
B. C(s)+H2O(g)+H2(g)==CH3OH(g)△H=+41.1kJ·mol—1
C. △H2>△H3
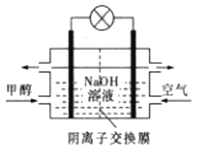
D. 如图所示为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e—+6OH—=CO2↑+5H2O
【答案】B
【解析】
A催化液化I的反应的△H<0、△S<0,则该反应在低温下能自发进行,故错误;
B.①“气化”:C(s)+2H2O(g)===CO2(g)+2H2(g)ΔH1=+90.1kJ·mol—1,②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ· mol—1,根据盖斯定律,①+②可得热化学方程式为: C(s)+H2O(g)+H2(g)=CH3OH(g) ΔH=(+90.1-49.0) kJ·mol—1=+41.1 kJ·mol—1,故正确;
C.②催化液化I:CO2(g)+3H2(g)===CH3OH(g)+H2O(g)△H2=-49.0kJ· mol—1,③催化液化Ⅱ:CO2(g)+2H2(g)===CH3OH(g)+![]() O2(g) △H3=akJ·mol—1,根据盖斯定律,②-③可得热化学方程式为:H2(g)+
O2(g) △H3=akJ·mol—1,根据盖斯定律,②-③可得热化学方程式为:H2(g)+![]() O2(g)=H2O(g) ΔH=△H2-△H3=(-49.0-a) kJ·mol—1,该反应为放热反应,即△H<0,则有△H2-△H3<0,即△H2<△H3,故错误;
O2(g)=H2O(g) ΔH=△H2-△H3=(-49.0-a) kJ·mol—1,该反应为放热反应,即△H<0,则有△H2-△H3<0,即△H2<△H3,故错误;
D.如图为甲醇燃料电池的工作原理示意图,负极的电极反应为CH3OH-6e-+8OH-=CO32-+6H2O,故错误;
故选B。





