题目内容
常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A、0.1mol/L (NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)+c(Fe2+)=0.3mol/L |
| B、0.1mol?L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-) |
| C、pH=8.0的KHS溶液中:c(K+)>c(HS-)>c(OH)>c(S2)>c(H+) |
| D、常温下,将10mL 0.1mol?L-1的盐酸与20mL 0.1mol?L-1的氨水混合,所得溶液中:c(NH3?H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
考点:离子浓度大小的比较
专题:离子反应专题
分析:A.任何溶液中都存在物料守恒,根据物料守恒判断;
B.任何溶液中都存在物料守恒,根据物料守恒判断;
C.pH=8.0的KHS溶液中HS-水解程度大于电离程度;
D.二者混合后溶液中的溶质为等物质的量浓度的氯化铵和一水合氨,一水合氨电离程度大于铵根离子水解程度,溶液呈碱性.
B.任何溶液中都存在物料守恒,根据物料守恒判断;
C.pH=8.0的KHS溶液中HS-水解程度大于电离程度;
D.二者混合后溶液中的溶质为等物质的量浓度的氯化铵和一水合氨,一水合氨电离程度大于铵根离子水解程度,溶液呈碱性.
解答:
解:A.任何溶液中都存在物料守恒,根据物料守恒得c(NH4+)+c(NH3?H2O)+c(Fe2+)+c(Fe(OH)3)=0.3mol/L,故A错误;
B.任何溶液中都存在物料守恒,根据物料守恒得c(NH4+)+c(NH3?H2O)=c(HS-)+c(H2S)+c(S2-),所以得c(NH4+)<c(HS-)+c(H2S)+c(S2-),故B正确;
C.pH=8.0的KHS溶液中HS-水解程度大于电离程度,溶液中水和硫氢根离子都电离出氢离子,只有硫氢根离子电离出硫离子,所以c(S2)<c(H+),故C错误;
D.二者混合后溶液中的溶质为等物质的量浓度的氯化铵和一水合氨,一水合氨电离程度大于铵根离子水解程度,溶液呈碱性,所以c(NH3?H2O)<c(NH4+),故D错误;
故选B.
B.任何溶液中都存在物料守恒,根据物料守恒得c(NH4+)+c(NH3?H2O)=c(HS-)+c(H2S)+c(S2-),所以得c(NH4+)<c(HS-)+c(H2S)+c(S2-),故B正确;
C.pH=8.0的KHS溶液中HS-水解程度大于电离程度,溶液中水和硫氢根离子都电离出氢离子,只有硫氢根离子电离出硫离子,所以c(S2)<c(H+),故C错误;
D.二者混合后溶液中的溶质为等物质的量浓度的氯化铵和一水合氨,一水合氨电离程度大于铵根离子水解程度,溶液呈碱性,所以c(NH3?H2O)<c(NH4+),故D错误;
故选B.
点评:本题考查了离子浓度大小比较,根据溶液中的溶质及溶液酸碱性再结合守恒思想分析解答,注意C中c(S2)、c(H+)的比较,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
根据物质的组成对物质进行分类,Na2CO3属于( )
| A、盐 | B、有机物 | C、碱 | D、氧化物 |
下列反应的离子方程式书写正确的是( )
| A、盐酸与氢氧化钠溶液反应:H++OH-═H2O |
| B、锌粒与稀醋酸反应:Zn+2H+═Zn2++H2↑ |
| C、氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ |
| D、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- |
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3.则下列说法正确的是( )
| A、反应过程中,被氧化与被还原的元素的物质的量之比为2:1 |
| B、NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C、一旦NF3泄漏,可以用石灰水溶液喷淋的方法减少污染 |
| D、若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
关于下列各装置图的叙述中,正确的是( )
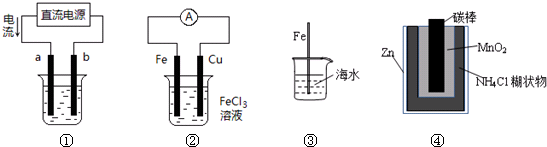

| A、用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液 |
| B、装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ |
| C、装置③中插入海水中的铁棒,越靠近底端腐蚀越严重 |
| D、装置④中Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、100mL 1 mol?L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
| B、等物质的量的N2和CO的质量均为28g |
| C、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、100mL 1mol/L的Na3PO4溶液中含有离子数多于0.4NA |
有温度、容积相同的甲、乙两个密闭容器.往甲容器中通入1g N2和1g H2,乙容器中通入2g N2和2g H2,保持恒温、恒容达到平衡,相关参数比较正确的是( )
| A、平衡时N2的转化率:α甲>2α乙 |
| B、平衡时NH3的浓度:2c甲<c乙 |
| C、平衡时体系压强:2p甲>p乙 |
| D、反应放出的热量:2Q甲>Q |
下列叙述中正确的是( )
| A、1mol任何纯净物都含有相同的分子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol氢中含有2mol氢原子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |
下列说法正确的是( )
| A、能与酸反应生成盐和水的氧化物一定是碱性氧化物 |
| B、把SO2通入溴水中,溴水立即褪色,这是由于SO2具有漂白作用 |
| C、将Ba(OH)2溶液滴到明矾溶液中,当SO42-恰好沉淀完全时,铝只以AlO2-形式存在 |
| D、在含有Cu(NO3)2、Mg(NO3)2、Fe(NO3)3溶液中加入过量锌粉,最先被还原的是Cu2+ |