题目内容
【题目】工业制氢气的一个重要反应是:CO(g)+H2O(g)![]() CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡状态所需时间/min | ||
CO | H2O | H2 | CO2 | |||
I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
II | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
①对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g),下列说法正确的是_________
CO2(g)+H2(g),下列说法正确的是_________
A.当容器中CO的含量保持不变时,说明该反应达到平衡状态
B.若混合气体的密度不再改变,说明该反应已达化学平衡状态
C.实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,H2的体积分数增大
D.若使用催化剂,会改变反应的途径,但反应的焓变不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率v(CO)=_________ ;
③实验II条件下反应的平衡常数K=_________ (保留小数点后二位);H2O(g)的平衡转化率为_______。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则平衡向______方向移动(填“正反应”、“逆反应”或“不移动”)
【答案】AD 0.16mol/l/min 0.33 50% 正反应
【解析】
①根据反应平衡移动即判断平衡标志和催化剂反应特点判断
②先计算CO改变量,再计算反应速率。
③先计算平衡时各物质的量,再计算平衡常数和平衡转化率。
④先计算浓度商,与K相比较得出平衡向哪个方向移动。
①A选项,CO开始反应时,含量减少,当容器中CO的含量保持不变时,说明该反应达到平衡状态,故A正确;
B选项,气体质量不变,容器体积不变,因此混合气体的密度不再改变,说明该反应不能说化学平衡状态,故B错误;
C选项,实验I中,反应达到平衡后,再通入4molCO和2molH2O,平衡正向移动,用建模思想考虑,相当于两个容器达到平衡后再加压,平衡不移动,因此H2的体积分数不变,故C错误;
D选项,若使用催化剂,会改变反应的途径,但反应的焓变不变,故D正确;
综上所述,答案为AD。
②实验I中,从反应开始到反应达到平衡时,氢气物质的量为1.6mol,则CO改变量为1.6mol,因此CO的平均反应速率![]() ;
;
故答案为:0.16 mol·L-1·min-1;
③实验II条件下反应达到平衡时,氢气物质的量为0.5mol,二氧化碳物质的量为0.5mol,一氧化碳物质的量为1.5mol,水蒸气物质的量为0.5mol,此时平衡常数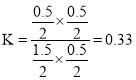 ;H2O(g)的平衡转化率为
;H2O(g)的平衡转化率为![]() ;
;
故答案为:0.33;50%。
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1.5molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,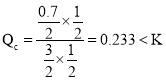 ,因此平衡向正反应方向移动;
,因此平衡向正反应方向移动;
故答案为:正反应。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
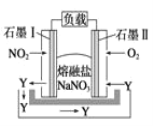
小学生10分钟应用题系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
2NH3(g) △H<0;其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
①比较K1、K2的大小:K1___________ K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是____________(填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.混合气体中氢气的质量不变
C.容器内压强保持不变 D.混合气体的密度保持不变
③某温度下,在一个10L的固定容器中充入2molN2和4molH2进行如下反应:N2(g)+3H2(g)![]() 2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
2NH3(g);H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K=_______________(mol/L)-2 ,平衡时NH3的体积分数为_______。
(2)肼(N2H4)高效清洁的火箭燃料。8g气态肼在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为_____________________。