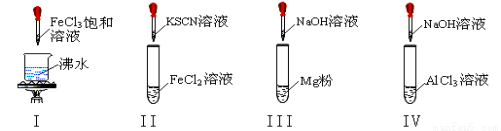
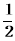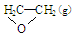题目内容
有人建议用AG表示溶液酸度,AG定义为 AG=lg[c(H+)/c(OH-)]。回答下列问题:
(1)25℃时,溶液的AG与其pH之间的关系为AG= 。
(2)25℃时,一元弱碱MOH溶液的AG=-8。取20mL该MOH溶液,当与16.2mL 0.05 mol/L硫酸混合时,两者恰好完全中和。求此条件下该一元弱碱的电离平衡常数。
(1)AG = 2×(7-pH) (2)1.25×10-5 mol/L
【解析】
试题分析:(1)pH=-lgc(H+).25℃时AG=lg[c(H+)/c(OH-)]=lg c(H+)-lg c(OH-)= lg c(H+)-lg 10-14/c(H+)= 2lg c(H+)+14=2×(7-pH)。(2)MOH溶液的AG=-8,则pH=11.c(OH-)=10-3mol/L二者发生反应的方程式为2MOH+H2SO4=M2SO4+2H2O。n(H2SO4) = 0.0162L ×0.05 mol/L=8.1×10-4mol.所以c(MOH)= (2×8.1×10-4mol)÷0.02L=0.081mol/L.因此该一元弱碱的电离平衡常数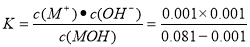 =1.25×10-5 mol/L
=1.25×10-5 mol/L
考点:考查AG与其pH之间的关系、弱电解质的大量平衡常数的计算的知识。

练习册系列答案
相关题目