题目内容
13. 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则N2(g)+3H2(g)═2NH3(g)的△H=-92.4kJ/mol.
(2)工业合成氨气的反应为N2(g)+3H2(g)?2NH3(g).在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是①②.
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,实验室还可在氢氧化钠固体(填一种试剂)中滴加浓氨水的方法快速制取少量氨气.
②常温下氨气极易溶于水,溶液可以导电.氨水中水电离出的c(OH-)< 10-7 mol•L-1(填写“>”、“<”或“=”);
③将相同体积、pH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
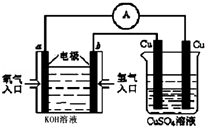
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景.现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒).如图所示:
右边Cu电极反应式是Cu-2e-=Cu2+.
a电极的电极反应式O2+2H2O+4e-=4OH-.
分析 (1)根据盖斯定律来计算化学反应的焓变即可;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,根据影响化学平衡移动的因素以及影响化学平衡常数的因素来回答;
(3)①NaOH和浓氨水也可以制取氨气;
②酸或碱抑制水电离;
③氨水可以和盐酸之间发生反应得到氯化铵溶液,根据离子浓度大小比较方法来回答;
(4)左边装置是燃料电池,通入氢气的电极是负极、通入氧气的电极是正极,右边装置在电解池,左边Cu是阴极、右边Cu是阳极,阳极上Cu失电子发生氧化反应;通入氧气的电极上氧气得电子和水反应生成氢氧根离子.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则反应N2(g)+3H2(g)═2NH3(g)可以是①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得到,
所以该反应的△H=180.5kJ•mol-1+(-483.6kJ•mol-1)×$\frac{3}{2}$-(-905kJ•mol-1)×$\frac{1}{2}$=-92.4kJ/mol,
故答案为:-92.4kJ/mol;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,增大反应物浓度化学平衡正向移动,增大压强,化学平衡向着气体系数和减小的方向移动,
故答案为:①②;
(3)①NaOH溶解放出热量,一水合氨分解吸收热量,所以加入NaOH溶解后氢氧根离子浓度增大,抑制氨气溶解,则能生成氨气,故答案为:氢氧化钠固体;
②酸或碱抑制水电离,一水合氨电离出氢氧根离子而抑制水电离,所以水电离出的c(OH-)<10-7 mol•L-1,故答案为:<;
③将相同体积、pH之和为14的氨水和盐酸混合后,所得的溶液是氯化铵和氨水的混合物,溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)左边装置是燃料电池,通入氢气的电极是负极、通入氧气的电极是正极,右边装置在电解池,左边Cu是阴极、右边Cu是阳极,阳极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+;通入氧气的电极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:Cu-2e-=Cu2+;O2+2H2O+4e-=4OH-.
点评 本题考查较综合,涉及原电池原理、离子浓度大小比较、盖斯定律、化学平衡状态判断等知识点,为高频考点,难点是电极反应式的书写,要结合电解质溶液酸碱性书写;注意化学平衡状态判断方法,题目难度不大.

| A. | .氢氧根离子的电子式是: | |
| B. | •二氧化碳分子的比例模型是 | |
| C. | .芳香烃的组成通式是CnH2n-6(n≥6) | |
| D. | .12C和14C的原子结构示意图均可表示为  |
| A. | 有单质参加或有单质生成的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应属于氧化还原反应,因为单质中元素化合价必然发生变化 | |
| C. | 没有单质参加的化合反应一定是非氧化还原反应 | |
| D. | 氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原 |
| A. | Na2O2可用作呼吸面具供氧剂,它还可以用于消毒、杀菌和漂白 | |
| B. | NaH可用于和水反应制取氢气,NaH是共价化合物 | |
| C. | Na2CO3的水溶液可用于油污的去除,其热溶液去污效果更好 | |
| D. | 侯氏制碱法,首先制取的是NaHCO3,NaHCO3受热分解生成碳酸钠 |
| A. | 反应混合物中各组分的浓度相等 | B. | 混合气体的密度不再改变 | ||
| C. | 混合气体的压强不再变化 | D. | 两种物质C、D的反应速率之比为1:1 |
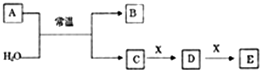 A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解.
A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解. H++Cl-+HClO;
H++Cl-+HClO;