题目内容
5. 实验室用如图装置制备硝基苯,主要步骤如下:
实验室用如图装置制备硝基苯,主要步骤如下:①配置一定比例弄硝酸与浓硫酸的混合物,加入反应器中.
②向室温下的混合酸中逐滴加入一定量的苯,充分震荡,混合均匀.
③在50°C~60°C下发生反应,直至反应结束.冷却后反应混合物分层,下层为黄色油状液体.
④将反应后混合物先用蒸馏水洗涤除去混合酸,再用5%NaOH溶液洗涤,最后再用蒸馏水洗涤.
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯.
填写下列空白:
(1)写出制备硝基苯的化学方程式
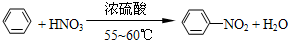 .
.(2)步骤③中,为使反应在50°C~60°C下进行,常用的方法是水浴加热.
(3)步骤④中洗涤、分离粗硝基苯应使用的仪器是分液漏斗.
(4)步骤④中粗产品用5%的NaOH溶液洗涤除去反应过程中生成的NO2,生成两种盐,其中一种是NaNO2,则反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O.
(5)纯硝基苯是无色、密度比水大(选填“大”或“小”),易溶(选填“易溶”或“可溶”或“难溶”)于水的油状液体.
分析 (1)苯与硝酸发生取代反应生成硝基苯和水,据此写出反应的化学方程式;
(2)由于控制温度50-60℃,应采取50~60℃水浴加热;
(3)分离互不相溶的液态,采取分液操作,需要用分液漏斗;
(4)二氧化氮与NaOH反应生成亚硝酸钠、硝酸钠和水;
(5)硝基苯的密度比水大,难溶于水.
解答 解:(1)制备硝基苯的化学方程式为: ,
,
故答案为: ;
;
(2)由于控制温度50-60℃,应采取50~60℃水浴加热,
故答案为:水浴加热;
(3)硝基苯是油状液体,与水不互溶,分离互不相溶的液态,采取分液操作,需要用分液漏斗,
故答案为:分液漏斗;
(4)二氧化氮与NaOH反应生成亚硝酸钠、硝酸钠和水,其反应的离子方程式为:2NO2+2OH-=NO2-+NO3-+H2O,
故答案为:2NO2+2OH-=NO2-+NO3-+H2O;
(5)硝基苯是一种无色油状液体,难溶于水,硝基苯的密度比水大,
故答案为:大;难溶.
点评 本题考查了制备方案的设计,题目难度中等,明确制备原理为解答关键,注意掌握物质制备方案的设计与评价原则,试题充分考查了学生的分析能力及化学实验能力.

练习册系列答案
相关题目
15.在恒温恒容的容器中进行反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g),若氮气浓度由0.1mol•L-1降到0.06mol•L-1需2s,那么由0.06mol•L-1降到0.024mol•L-1需要的反应时间为( )
| A. | 等于1.8 s | B. | 等于1.2 s | C. | 大于1.8 s | D. | 小于1.8 s |
16.下列说法中,正确的是( )
| A. | 盐溶液都呈中性 | |
| B. | 有挥发性的药品都需要密封保存 | |
| C. | 温度达到着火点的可燃物都一定燃烧 | |
| D. | 有单质和化合物生成的反应都是置换反应 |
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 0.1 mol甲烷含有的电子数为NA | |
| B. | 1 L 0.1 mol/L Na2CO3溶液中含有的CO32-数目为0.1 NA | |
| C. | 1 L pH=1的硫酸溶液中含有的H+数为0.2 NA | |
| D. | 1 mol•L-1 FeCl3溶液中所含Cl-的数目为3NA |
10.强酸和强碱的稀溶液的中和热可表示为:H+(aq)+OH-(aq)═H2O(1)△H═-57.3kJ/mol 已知:
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O△H═-Q1kJ/mol
H2SO4(浓)+NaOH(aq)═Na2SO4(aq)+H2O(1)△H═-Q2kJ/mol
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(1)△H═-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O△H═-Q1kJ/mol
H2SO4(浓)+NaOH(aq)═Na2SO4(aq)+H2O(1)△H═-Q2kJ/mol
HNO3(aq)+KOH(aq)═KNO3(aq)+H2O(1)△H═-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
| A. | Q1=Q2=Q3 | B. | Q2>Q1>Q3 | C. | Q2>Q3>Q1 | D. | Q2=Q3>Q1 |
17.下列物质的分类正确的一组是( )
| A | B | C | D | |
| 电解质 | NH3 | Na2CO3 | NH4NO3 | Fe(OH)3 |
| 混合物 | 漂白粉 | 明矾 | 水玻璃 | 冰水混合物 |
| 酸性氧化物 | CO2 | NO2 | SiO2 | CO |
| 酸 | HClO | CH3COOH | H2SiO3 | HNO3 |
| A. | A | B. | B | C. | C | D. | D |
14.金刚石和石墨是碳元素的两种结构不同的单质(同素异形体).在100kPa时,1mol金刚石转化为石墨,会放出1.895kJ的热量.据此,试判断在100kPa压强下,下列结论正确的是( )
| A. | 1mol石墨比1mol金刚石的总能量低 | |
| B. | 1mol石墨比1mol金刚石的总能量高 | |
| C. | 金刚石比石墨稳定 | |
| D. | 无法判断石墨和金刚石的相对稳定性 |
15.由短周期两种元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne原子相同的核外电子层结构,下列说法不正确的是( )
| A. | A2B3是三氧化二铝 | B. | A3+与B2-最外层上的电子数相同 | ||
| C. | A是第3周期第ⅢA族的元素 | D. | B是第3周期第ⅥA族的元素 |