题目内容
已知 2Fe3++2I-=2Fe2++I2,2Fe2++Cl2=2Fe3++2Cl-,则有关离子的还原性由强到弱的顺序为( )
分析:根据还原剂的还原性大于还原产物的还原性判断.
解答:解:在同一反应中,还原剂的还原性大于还原产物的还原性.
2Fe3++2 I-=2 Fe2++I2,该反应中还原剂是I-,还原产物是Fe2+,所以 I-的还原性大于Fe2+ 的还原性;
2Fe2++Cl2=2Fe3++2Cl-,该反应中还原剂是Fe2+,还原产物是Cl-,所以Fe2+的还原性大于Cl-的还原性;
有关离子的还原性由强到弱的顺序为:I->Fe2+>Cl-;
故选C.
2Fe3++2 I-=2 Fe2++I2,该反应中还原剂是I-,还原产物是Fe2+,所以 I-的还原性大于Fe2+ 的还原性;
2Fe2++Cl2=2Fe3++2Cl-,该反应中还原剂是Fe2+,还原产物是Cl-,所以Fe2+的还原性大于Cl-的还原性;
有关离子的还原性由强到弱的顺序为:I->Fe2+>Cl-;
故选C.
点评:本题考查了还原性强弱的比较,还原性的强弱与失电子的难易程度有关,与失电子的多少无关.

练习册系列答案
相关题目
常温下,将FeCl3溶液和KI溶液混合,发生如下反应:
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mL CCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
已知:v(正)=k?cm(I-)?cn(Fe3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是 .加入四氯化碳的作用是 .
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
分析实验记录,甲认为导致Fe3+浓度过低的原因是 ;乙同学结合平衡移动的知识,认为还有一个原因是 .
(3)该反应的平衡常数表达式为 .
(4)已知改变I-、Fe3+的浓度,正反应速率对应数值如下表所示:
分析表中数据,I-浓度对反应速率的影响 Fe3+浓度对反应速率的影响(填“大于”、“小于”或“等于”),理由是(写出计算过程) .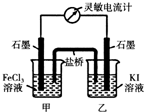
(5)现将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池
①能说明反应达到平衡的标志是 (填序号).
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时 (填“甲“或“乙”)中石墨电极为负极,对应的电极反应方程式为 .
2Fe3++2I-?2Fe2++I2
某研究小组为了证明FeCl3溶液和KI溶液的反应存在一定限度,设计了如下实验:取5mL 0.1mol?L-1 KI溶液,滴加0.1mol?L-1 FeCl3溶液5~6滴,充分反应后溶液呈黄褐色,加入2mL CCl4溶液,振荡后静置,取上层溶液,滴加KSCN试剂,观察实验现象.
已知:v(正)=k?cm(I-)?cn(Fe3+)(k为常数)
根据以上信息回答下列问题:
(1)能够证明反应存在限度的现象是
(2)甲同学按上述步骤进行实验,结果并未观察到预期现象,推测可能原因是反应后溶液中Fe3+浓度过低.为此,甲又做了下列对比实验,实验结果记录如下:
| 氯化铁溶液用量 | 10滴 | 20滴 | 30滴 | 2mL | 3mL | 4mL |
| 萃取后上层溶液颜色 | 黄色 | 黄色 | 黄色 | 较深黄色 | 黄色略带红色 | 黄红色 |
| 加入KSCN溶液后颜色 | 不变红 | 不变红 | 略变红 | 偏血红色 | 血红色 | 血红色 |
(3)该反应的平衡常数表达式为
(4)已知改变I-、Fe3+的浓度,正反应速率对应数值如下表所示:
| c(I-)/mol?L-1 | c(Fe3+)/mol?L-1 | v/mol?L-1?s-1 | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |

(5)现将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池
①能说明反应达到平衡的标志是
a.电流计读数为零 b.电流计指针不再偏转且不为零
c.电流计指针偏转角度最大 d.甲烧杯中溶液颜色不再改变
②反应达平衡后,向甲中加入适量FeCl2固体,此时
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).