题目内容
【题目】下列措施或事实不能用勒沙特列原理解释的是 ( )
A.滴加酚酞的氨水中加入氯化铵固体后红色变浅
B.棕红色的NO2加压后颜色先变深后变浅(已知: 2NO2 (g) ![]() N2O4 (g))
N2O4 (g))
C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率
D.用硫酸氢钠去除暖水瓶中的水垢
【答案】D
【解析】
试题分析:勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释。A.因为氨水中存在一水合氨的电离平衡,向滴加酚酞的氨水中加入氯化铵,铵根离子浓 度增大,抑制一水合氨的电离,氢氧根离子浓度降低,溶液颜色变浅,能用勒夏特列原理解释,故A不选;B.加压二氧化氮的浓度增大,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,但仍比原来的颜色深,可用勒夏特列原理解释,故B不选;C.存在2SO2+O2![]() 2SO3,过量的空气使平衡正向移动,二氧化硫的转化率增大,能用勒夏特列原理解释,故C不选;D.用硫酸氢钠去除暖水瓶中的水垢利用的是硫酸氢钠溶液显酸性,不存在平衡移动,所以不能用勒夏特里原理解释,故D选;答案选D。
2SO3,过量的空气使平衡正向移动,二氧化硫的转化率增大,能用勒夏特列原理解释,故C不选;D.用硫酸氢钠去除暖水瓶中的水垢利用的是硫酸氢钠溶液显酸性,不存在平衡移动,所以不能用勒夏特里原理解释,故D选;答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】某探究小组用HNO3 与大理石反应过程中质量减小的方法研究影响反应速率的因素。所用HNO3浓度为1.00mol/L、2.00mol/L,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HN03 的用量为25.0mL、大理石用量为10.00g。
(1)请完成以下实验设计表,在实验目的一栏中填出对应的实验编号:
试验编号 | T/K | 大理石规格 | HNO3浓度mol/L | 实验目的 |
① | 298 | 粗颗粒 | 2.00 | 实验①和②探究HNO3 浓度对该反应速率的影响; (II)实验①和____探究温度对该反应速率的影响; (III)实验①和____探究大理石规格(粗、细)对该反应速率的影响。 |
② | 298 | 粗颗粒 | 1.00 | |
③ | 308 | 粗颗粒 | 2.00 | |
④ | 298 | 细颗粒 | 2.00 |
(2)实验①中CO2质量随时间变化的关系见图:

依据反应方程式CaCO3+2HNO3=Ca(NO3)2+CO2↑+H2O,计算实验①在70~90s范围内HNO3的平均反应速率_______。(忽略溶液体积变化)
(3)请在上图中,画出实验②和③中CO2质量随时间变化关系的预期结果示意图,并标出线的序号_______。
(4)工业上己实现CO2和H2反应生成甲醇的转化。己知:在一恒温、恒容密闭容器中充入1mol CO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。测得CO2和CH3OH (g)的浓度随时间变化如下图所示。请回答:
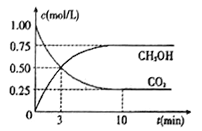
①达到平衡时H2的转化率为_______。在前10min内,用CO2表示的反应速率:V(CO2)=______mol/(L·min)
②能判断该反应达到化学平衡状态的依据是_______。
a.容器压强不变 b.混合气体中c(CO2)不变
c. v(CH3OH)=v(H2O) d. c(CH3OH)=c(H2O)