题目内容
【题目】实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是(填序号),仪器C的名称是 , 本实验所需玻璃仪器E规格和名称是 . 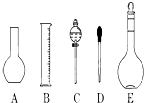
(2)下列操作中,容量瓶所不具备的功能有 (填序号).
A.配制一定体积准确浓度的标准溶液
B.长期贮存溶液
C.用来加热溶解固体溶质
D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用mL规格的量筒最好.
(5)如果定容时不小心超过刻度线,应如何操作 .
【答案】
(1)AC;分液漏斗;500mL容量瓶
(2)BCD
(3)小于;大于
(4)13.6;25.0
(5)重新配制
【解析】解:(1.)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,用不到的仪器:平底烧瓶和分液漏斗;仪器C的名称为分液漏斗;需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL,实验室没有450mL容量瓶,所以应选择500mL容量瓶; 故答案为:AC;分液漏斗;500mL容量瓶;
(2.)容量瓶只能用来配制一定体积准确浓度的溶液,不能配制或测量容量瓶规格以下的任意体积的液体,不能稀释或溶解药品,不能用来加热溶解固体溶质,
故选:BCD;
(3.)若定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏小;
若NaOH溶液未冷却即转移至容量瓶定容,冷却后,溶液体积偏小,溶液浓度偏大;故答案为:小于;大于;
(4.)质量分数为98%、密度为1.84g/cm3的浓硫酸物质的量浓度C= ![]() =18.4mol/L,设0.5mol/L硫酸溶液500mL需要浓硫酸体积为V,则依据溶液稀释过程溶液所含溶质的物质的量保持不变得:V×18.4mol/L=0.5mol/L×500mL,解得V=13.6mL,用选择25mL量筒;
=18.4mol/L,设0.5mol/L硫酸溶液500mL需要浓硫酸体积为V,则依据溶液稀释过程溶液所含溶质的物质的量保持不变得:V×18.4mol/L=0.5mol/L×500mL,解得V=13.6mL,用选择25mL量筒;
故答案为;13.6;25.0;
(5.)如果定容时不小心超过刻度线,实验失败,且不能补救,必须重新配制;
故答案为:重新配制.
(1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器;确定用不到的和缺少的仪器;依据配制溶液的体积选择需要容量瓶规格;(2)容量瓶为精密仪器不能稀释浓溶液、不能用于溶解固体、储存溶液等;(3)分析操作对溶质的物质的量和溶液体积的影响,依据C= ![]() 进行误差分析;(4)依据C=
进行误差分析;(4)依据C= ![]() 计算浓硫酸的物质的量浓度;溶液稀释过程溶液所含溶质的物质的量保持不变,据此计算需要浓硫酸体积和使用量筒规格;(5)错误的操作发生后,能补救的就补救,不能补救的则重新配制;
计算浓硫酸的物质的量浓度;溶液稀释过程溶液所含溶质的物质的量保持不变,据此计算需要浓硫酸体积和使用量筒规格;(5)错误的操作发生后,能补救的就补救,不能补救的则重新配制;

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案