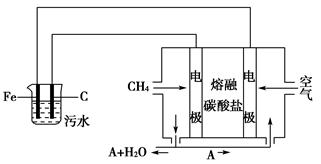
题目内容
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )
| A.原电池放电时,负极上发生反应的物质是Zn |
| B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2 |
| C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强 |
| D.溶液中OH-向正极移动,K+、H+向负极移动 |
D
根据总反应Ag2O+Zn+H2O=2Ag+Zn(OH)2分析化合价变化可知,Zn在负极上失电子,Ag2O在正极上得电子,电解质溶液为KOH溶液,所以负极反应为Zn+2OH--2e-=Zn(OH)2,正极反应为Ag2O+2e-+H2O=2Ag+2OH-。在负极区,OH-被消耗,溶液碱性减弱,溶液中的OH-作定向移动到负极来补充,正极区生成OH-,溶液碱性增强,故D项错误。

练习册系列答案
相关题目