题目内容
12.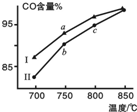 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )| A. | 相同条件下,催化剂Ⅱ催化效率更高 | |
| B. | b点表示上述反应在对应条件下的平衡状态 | |
| C. | 根据图象,无法判断该反应是否为吸热反应 | |
| D. | 该反应平衡常数表达式为K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})}$ |
分析 根据图象,达平衡前,反应在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,CO的含量为Ⅰ>Ⅱ,结合催化剂只改变反应速率不改变平衡移动,所以最终不同催化剂(Ⅰ、Ⅱ)作用下达平衡时CO的含量相同,据此分析.
解答 解:A、根据图象,达平衡前,反应在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,CO的含量为Ⅰ>Ⅱ,所以催化剂Ⅰ催化效率更高,故A错误;
B、因为催化剂只改变反应速率不改变平衡移动,所以最终不同催化剂(Ⅰ、Ⅱ)作用下达平衡时CO的含量相同,故b点所代表的状态不是平衡状态,故B错误;
C、此时反应一直向正反应方向移动,未达到平衡状态,所以不能通过温度改变说明反应是否为吸热反应,故C正确;
D、该反应平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}){\;}^{3}}{c(CH{\;}_{4})c(H{\;}_{2}O)}$,故D错误;
故选:C.
点评 本题考查了化学平衡的影响因素以及平衡常数的表达式等,题目难度中等,注意明确化学平衡的影响因素.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
3.下列化学方程式书写错误的是( )
| A. | 乙醇催化氧化制取乙醛:2CH3CH2OH+O2 $→_{△}^{催化剂}$2CH3CHO+2H2O | |
| B. | 苯与浓硫酸、浓硝酸的混合液共热制硝基苯: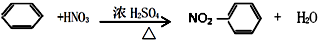 | |
| C. | 乙酸和乙醇发生反应生成乙酸乙酯:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3 | |
| D. | 乙烯使溴的四氯化碳溶液褪色:CH2=CH2+Br2→CH2Br-CH2Br |
20.如图表示物质通过一步反应的转化关系,下列说法正确的是( )
X$\stackrel{O_{2}}{→}$酸性氧化物→酸.
X$\stackrel{O_{2}}{→}$酸性氧化物→酸.
| A. | X可能是Al单质 | B. | X可能是H2 | ||
| C. | 酸可能为H2SO4 | D. | 酸性氧化物可能为SiO2 |
17.下列各组中的反应,属于同一反应类型的是( )
| A. | 由2-溴丙烷制2-丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯制对硝基甲苯;由甲苯制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯与溴水反应制1,2-二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯与水反应制苯甲酸和乙醇 |
4.我国科学家报道了如图所示的水溶液锂离子电池体系.下列叙述正确的是( )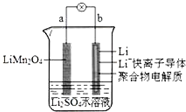

| A. | a为电池的负极 | |
| B. | 放电时,溶液中的Li+从a向b迁移 | |
| C. | 放电时,a极锂元素的化合价发生变化 | |
| D. | 电池充电反应为LiMn2O4=Li1-xMn2O4+xLi |
1.下列有关电子排布图的表述正确的是( )
| A. | 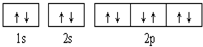 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 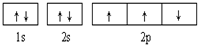 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 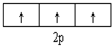 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |
2.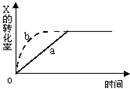 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
 图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )
图中a曲线表示一定条件下可逆反应:X(g)+Y(g)?2Z(g)+W(s),△H<0的反应过程,若使 a曲线变为b曲线,可采用的措施是( )| A. | 增大体积 | B. | 增大Y的浓度 | C. | 缩小体积 | D. | 降低温度 |
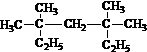 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; ;
; ;
; .
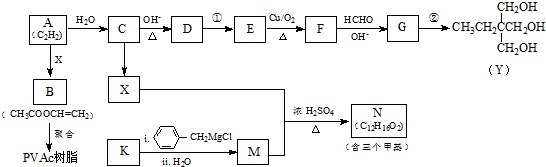
.
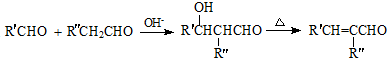
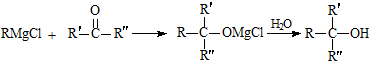
 .
. .
.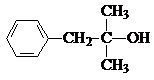 .
. .
.