题目内容
13. 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:(1)R元素的原子结构示意图为
 ;W在周期表中的位置是第三周期VIA族;
;W在周期表中的位置是第三周期VIA族;Q的最高价氧化物的电子式为
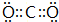 .
.(2)Q、R、T三种元素原子的半径从大到小排列的顺序为:Al>C>N(用元素符号表示);
Q元素与R元素的最高价氧化物的水化物的酸性强弱关系为:HNO3>H2CO3(用化学式表示).
分析 根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素.
(1)R为N元素,原子核外有7个电子,有2个电子层,各层电子数为2、5;主族元素周期数=电子层数、主族元素族序数=最外层电子数;Q的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对;(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大;元素非金属性越强,最高价氧化物的水化物的酸性越强.
解答 解:根据短周期元素Q、R、T、W在元素周期表中的位置知,Q和R位于第二周期、T和W位于第三周期,T所处的周期序数与主族序数相等,则T是Al元素,可推知Q是C元素、R是N元素、W是S元素.
(1)(R为N元素,原子核外有7个电子,有2个电子层,各层电子数为2、5,原子结构示意图为 ;W为S元素,原子核外有3个电子层,最外层电子数为6,在周期表中的位置是第三周期VIA族;
;W为S元素,原子核外有3个电子层,最外层电子数为6,在周期表中的位置是第三周期VIA族;
Q的最高价氧化物为CO2,分子中C原子与氧原子之间形成2对共用电子对,电子式为: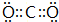 ,
,
故答案为: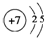 ;第三周期VIA族;
;第三周期VIA族;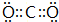 ;
;
(2)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Al>C>N;同周期自左而右元素非金属性增强,元素非金属性越强,最高价氧化物的水化物的酸性越强,故酸性:HNO3>H2CO3,
故答案为:Al>C>N;HNO3>H2CO3.
点评 本题考查结构性质位置关系应用,明确元素种类是解题关键,侧重对化学用语与元素周期律的考查,难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案
相关题目
4.下列叙述正确的是( )
| A. | 蔗糖与浓硫酸反应中有海绵状的炭生成,是因为浓硫酸具有吸水性能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体,体现浓硫酸的强氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥硫化氢、氢气等气体 | |
| D. | 浓硫酸在常温下可用铁桶盛装,是因为常温下浓硫酸能够使铁、铝等金属钝化 |
1.下列化学用语使用正确的是( )
| A. | 葡萄糖、淀粉的最简式都是CH2O | B. | CH4的电子式是 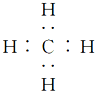 | ||
| C. | 乙醛分子的结构简式是CH3COH | D. | 丙烷分子的球棍模型是 |
8.下列反应类型中属于化学平衡主要研究对象的是( )
| A. | 化合反应 | B. | 离子反应 | C. | 可逆反应 | D. | 气体反应 |
18.有机化学与人类生活密切相关,下列说法不正确的是( )
| A. | PX(即对二甲苯)是苯的同系物,来源于煤和石油 | |
| B. | 乙二醇可用作汽车防冻液,甘油可用于配制化妆品 | |
| C. | 苯酚有毒,如不慎沾到皮肤上,应立即用氢氧化钠溶液洗涤 | |
| D. | 罐装液化石油气的主要成分有丙烷、丁烷、丙烯、丁烯等 |
2.下列实验操作中有错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,温度计水银球应浸没在液体中 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 把几滴FeCl3饱和溶液滴入250mL沸水中继续煮沸至红褐色制取Fe(OH)3胶体 |
3.下列实验操作中错误的是( )
| A. | 过滤时,玻璃棒应该紧靠三层滤纸处 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
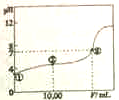 常温下,将0.1000mol.L-1NaOH溶液滴入20.00mL0.1000mol.L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示.
常温下,将0.1000mol.L-1NaOH溶液滴入20.00mL0.1000mol.L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示.