题目内容
【题目】已知氢氧化钠和氢氧化钡混合溶液的pH=14,现取100mL该混合溶液,加入100mL0.4mol/LH2SO4溶液时生成的沉淀已达最多(溶液的体积变化忽略不计),计算回答下列问题:(无计算过程不得分)
(1)原混合溶液中氢氧化钠和氢氧化钡的物质的量浓度为多少?____
(2)反应后所得溶液的pH为多少?____
【答案】c[Ba(OH)2]=0.4mol/L、c(NaOH)=0.2mol/L pH=13
【解析】
(1)氢氧化钠和氢氧化钡混合溶液的pH=14,则c(OH-)=1mol/L,100mL溶液中n(OH-)=0.1L×1mol/L=0.1mol,向混合溶液中加入硫酸,生成沉淀最多,发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,根据方程式可知n[Ba(OH)2]=n(H2SO4)=0.1L×0.4mol/L=0.04mol,故c[Ba(OH)2]=![]() =0.4mol/L,溶液中n(OH-)= n(NaOH)+ 2n[Ba(OH)2],故n(NaOH)=0.1mol-0.04mol×2=0.02mol,则c(NaOH)=
=0.4mol/L,溶液中n(OH-)= n(NaOH)+ 2n[Ba(OH)2],故n(NaOH)=0.1mol-0.04mol×2=0.02mol,则c(NaOH)=![]() =0.2mol/L;
=0.2mol/L;
(2)NaOH没有反应,反应后OH-的浓度为![]() =0.1mol/L,故c(H+)= 10-13mol/L,则反应后溶液pH=13。
=0.1mol/L,故c(H+)= 10-13mol/L,则反应后溶液pH=13。

练习册系列答案
相关题目
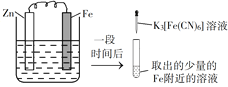
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼