题目内容
【化学——选修5:有机化学基础】目前,回收溴单质的方法主要有水蒸气蒸馏法和萃取法等.某兴趣小组通过查阅相关资料拟采用如下方案从富马酸废液(含溴0.27%)中回收易挥发的Br2:
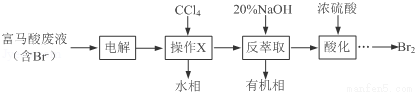
(1)操作X所需要的主要玻璃仪器为____________;反萃取时加入20%的NaOH溶液,其离子方程式为________________________.
(2)反萃取所得水相酸化时,需缓慢加入浓硫酸,并采用冰水浴冷却的原因是_________.
(3)溴的传统生产流程为先采用氯气氧化,再用空气水蒸气将Br2吹出.与传统工艺相比,萃取法的优点是____________________________.
(4)我国废水三级排放标准规定:废水中苯酚的含量不得超过1.00mg/L.实验室可用一定浓度的溴水测定某废水中苯酚的含量,其原理如下:
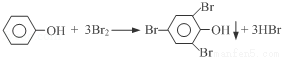
①请完成相应的实验步骤:
步骤1:准确量取25.00mL待测废水于250mL锥形瓶中.
步骤2:将4.5mL 0.02mol/L溴水迅速加入到锥形瓶中,塞紧瓶塞,振荡.
步骤3:打开瓶塞,向锥形瓶中加入过量的0.1mol/L KI溶液,振荡.
步骤4:____________________________,再用0.01mol/L Na2S2O3标准溶液滴定至终点,消耗 Na2S2O3溶液15mL.(反应原理:I2+2Na2S2O3=2NaI+Na2S4O6)
步骤5:将实验步骤1~4重复2次.
②该废水中苯酚的含量为____________mg/L.
③步骤3若持续时间较长,则测得的废水中苯酚的含量_________________(填“偏高”、“偏低”或“无影响”).
练习册系列答案
相关题目






 的浓度更大,其原因是__________________
的浓度更大,其原因是__________________