题目内容
X+、Y+、M2+、N2-均为含若干电子的短周期元素的简单离子,离子半径大小关系为:N2->Y+、Y+> X+、Y+>M2+、M2+> X+下列比较中正确的是( )
| A.原子半径:N可能比Y大,也可能比Y小 |
| B.M2+、N2-核外电子数:可能相等,也可能不相等 |
| C.原子序数:N>M>X>Y |
| D.碱性:M(OH)2>YOH |
B
离子半径大小判断原则:层数越多,半径越大,层数相同时,核电荷数越大,半径越小。
本题主要是根据离子所带电荷、离子半径的大小顺序(N2->Y+>M2+>X+)来判断该元素所处周期表位置,最终判定元素种类。
四离子均含电子,说明不可能是H+,故可判定X+、Y+为每IA族元素,因为离子半径Y+>X+,可知Y为钠元素,X为锂元素;
又由离子半径Y+>M2+>X+,可知M为镁元素;
又由N2->Y+可知N元素可为氧或硫元素;
A项:原子半径:Na>S、Na>O,所以N的原子半径一定比Y小
B项:当M2+、N2-分别为镁离子和氧离子时,核外电子数相同,当分别为镁离子与硫离子时,核外电子数后者大
C项:由于N元素不定,故原子序数大小不定
D项:碱性:NaOH>Mg(OH)2
故答案为B
本题主要是根据离子所带电荷、离子半径的大小顺序(N2->Y+>M2+>X+)来判断该元素所处周期表位置,最终判定元素种类。
四离子均含电子,说明不可能是H+,故可判定X+、Y+为每IA族元素,因为离子半径Y+>X+,可知Y为钠元素,X为锂元素;
又由离子半径Y+>M2+>X+,可知M为镁元素;
又由N2->Y+可知N元素可为氧或硫元素;
A项:原子半径:Na>S、Na>O,所以N的原子半径一定比Y小
B项:当M2+、N2-分别为镁离子和氧离子时,核外电子数相同,当分别为镁离子与硫离子时,核外电子数后者大
C项:由于N元素不定,故原子序数大小不定
D项:碱性:NaOH>Mg(OH)2
故答案为B

练习册系列答案
相关题目




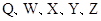 是原子序数依次增大的短周期元素,
是原子序数依次增大的短周期元素,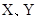 是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是
是金属元素,X的焰色呈黄色。五种元素核电荷数之和为54,最外层电子数之和为20。W、Z最外层电子数相同,Z的核电荷数W的2倍。工业上通过电解氧化物的方法获得Y的单质。则下列说法不正确的是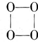 的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )
的O4是一种价格超过黄金的气体,下列有关O4的说法中不正确的是( )