题目内容
【题目】反应A(g)+B(g) ![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
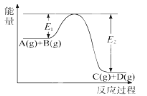
(1)该反应是________反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”、“减小”或“不变”),原因是________。
(3)反应体系中加入催化剂对反应热是否有影响_______(填“有”、“无”)。
(4)在反应体系中加入催化剂,反应速率增大,此时E1______,E2_______(填“增大”、“减小”或“不变”)。
【答案】放热 减小 温度升高,平衡逆向移动 无 减小 减小
【解析】
(1)根据反应物和生成物总能量的相对大小判断;
(2)根据温度对平衡状态的影响分析;
(3)根据催化剂对反应热的影响分析;
(4)根据催化剂对活化能和反应速率的影响分析。
(1)根据图像可判断反应物的总能量高于生物总能量,因此该反应是放热反应;
(2)正反应放热,平衡后升高温度,平衡向逆反应方向进行,A的转化率减小;
(3)由于催化剂只改变化学反应的速率和途径,不能改变化学反应的始态和终态的能量,因此对反应热没有影响;
(4)催化剂能降低反应的活化能,因此在反应体系中加入催化剂,反应速率增大,E1和E2均减小。

【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定,下列实验中用高锰酸钾与浓盐酸反应制备得到氯气,然后再将氯气通入氢氧化钾溶液中与氢氧化铁固体充分反应而制得产品:
(1)制备K2FeO4(夹持装置略)

①请写出该过程中制备氯气的离子反应方程式________________(锰被还原为Mn2+)。
②请根据高铁酸钾制备的原理选择合适的装置,连接顺序为_________→ E →_________。(上述装置不一定全部用到,装置可以重复选用)
③装置E中反应时需进行搅拌,目的是_______________________
④E中得到紫色固体和溶液。E中生成高铁酸钾的反应为______________;反应充分进行后,E中溶液中主要的阴离子为__________________
(2)探究K2FeO4的性质
取E中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否是K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤E中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
①由方案Ⅰ中溶液变红可知a中含有______离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
②方案Ⅱ可证明K2FeO4氧化了Cl-。用KOH溶液洗涤的目的是______________
【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
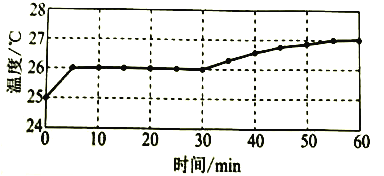
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
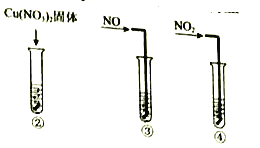
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
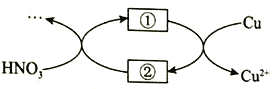
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。
【题目】将甘油![]() 转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得
转化为高附加值产品是当前的热点研究方向,如甘油和水蒸气、氧气经催化重整或部分催化氧化可制得![]() ,反应过程如下:
,反应过程如下:
反应Ⅰ |
| 甘油水蒸气重整 |
反应Ⅱ |
| 甘油部分氧化 |
反应Ⅲ |
| 甘油氧化水蒸气重整 |
下列说法正确的是( )
A. ![]() B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
B. 消耗等量的甘油,反应Ⅲ的放热效果最显著
C. 消耗等量的甘油,反应的产氢率最高D. 甘油不溶于水