��Ŀ����
���仯�����ڻ�ѧ��ҵ��Ӧ�÷dz��㷺��
��1������β������Ҫ����CO��NO2��SO2��CO2���壬����______�ܵ��¹⻯ѧ�������γɣ�
Ŀǰ���õ�������������װ���а�װһ����������������Ч�Ľ�β���е��к�����ת����
�磺CO��g��+NO2��g��?NO��g��+CO2��g����H=-akJ?mol-1��a��0��
2CO��g��+2NO��g��?N2��g��+2CO2��g����H=-bkJ?mol-1��b��0��
���ñ�״���µ�3.36L CO��ԭNO2��N2��CO��ȫ��Ӧ�������������зų�������Ϊ______kJ���ú���a��b�Ĵ���ʽ��ʾ����
��2����ҵ����������ʱ����SO2����ΪSO3�ǹؼ�һ����
��ij�¶��£���֪2SO2��g��+O2��g��?2SO3��g������H=-196kJ?mol-1����ʼʱ��10L���ܱ������м���4.0mol SO2��g����5.0mol O2��g����5���Ӻ�Ӧ�ﵽƽ�⣬���ų�����196kJ�����¶��´˷�Ӧ��ƽ�ⳣ��K=______����O2��ʾ�ķ�Ӧ����Ϊ______��
��һ�������£���һ���������ܱ������г���2mol SO2��1molO2���������з�Ӧ��2SO2��g��+O2��g��?2SO3��g�����ﵽƽ���ı�����������SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ���������______������ĸ����
A�������¶Ⱥ�����������䣬����2mol SO3
B�������¶Ⱥ�����������䣬����2mol N2
C�������¶Ⱥ�������ѹǿ���䣬����1mol SO3
D�������¶�
E���ƶ�����ѹ������
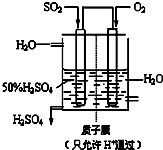
��3��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ______��
��1������β������Ҫ����CO��NO2��SO2��CO2���壬����______�ܵ��¹⻯ѧ�������γɣ�
Ŀǰ���õ�������������װ���а�װһ����������������Ч�Ľ�β���е��к�����ת����
�磺CO��g��+NO2��g��?NO��g��+CO2��g����H=-akJ?mol-1��a��0��
2CO��g��+2NO��g��?N2��g��+2CO2��g����H=-bkJ?mol-1��b��0��
���ñ�״���µ�3.36L CO��ԭNO2��N2��CO��ȫ��Ӧ�������������зų�������Ϊ______kJ���ú���a��b�Ĵ���ʽ��ʾ����
��2����ҵ����������ʱ����SO2����ΪSO3�ǹؼ�һ����
��ij�¶��£���֪2SO2��g��+O2��g��?2SO3��g������H=-196kJ?mol-1����ʼʱ��10L���ܱ������м���4.0mol SO2��g����5.0mol O2��g����5���Ӻ�Ӧ�ﵽƽ�⣬���ų�����196kJ�����¶��´˷�Ӧ��ƽ�ⳣ��K=______����O2��ʾ�ķ�Ӧ����Ϊ______��
��һ�������£���һ���������ܱ������г���2mol SO2��1molO2���������з�Ӧ��2SO2��g��+O2��g��?2SO3��g�����ﵽƽ���ı�����������SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ���������______������ĸ����

A�������¶Ⱥ�����������䣬����2mol SO3
B�������¶Ⱥ�����������䣬����2mol N2
C�������¶Ⱥ�������ѹǿ���䣬����1mol SO3
D�������¶�
E���ƶ�����ѹ������
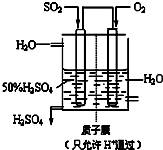
��3��ij����������ͼ��ʾװ���õ绯ѧԭ���������ᣬд��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ______��
��1������β������Ҫ����CO��NO2��SO2��CO2���壬���е�������������⻯ѧ������ԭ��NO2�ܵ��¹⻯ѧ�������γɣ�
��CO��g��+NO2��g��?NO��g��+CO2��g����H=-akJ?mol-1��a��0��
��2CO��g��+2NO��g��?N2��g��+2CO2��g����H=-bkJ?mol-1��b��0��
�١�2+�ڵõ���4CO��g��+2NO2��g��?4CO2��g��+N2��g����H=-��2a+b��kJ?mol-1
��״���µ�3.36L CO�����ʵ����T
=0.15mol�����ݺϲ��õ����Ȼ�ѧ����ʽ���Լ���õ���״��0.15molCO��ԭNO2��N2��CO��ȫ��Ӧ�������������зų�������Ϊ��
=
(2a+b)KJ��
�ʴ�Ϊ��NO2��
��
��2����2SO2��g��+O2��g��?2SO3��g������H=-196kJ?mol-1����ʼʱ��10L���ܱ������м���4.0mol SO2��g����5.0mol O2��g����5���Ӻ�Ӧ�ﵽƽ�⣬���ų�����196kJ������SO2�����ʵ���Ϊ2mol�����ݻ�ѧƽ����ʽ���㣺
2SO2 +O2?2SO3��
��ʼ����mol�� 4.0 5.0 0
�仯����mol�� 2.0 1.0 2.0
ƽ������mol�� 2.0 4.0 2.0
K=
=
=2.5 mol-1?L��
v��O2��=
=0.02 mol?L-1?min-1
��A�������¶Ⱥ�����������䣬����2mol SO3��ƽ�����淴Ӧ�����ƶ�����SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ������A��ȷ��
B�������¶Ⱥ�����������䣬����2mol N2����ƽ���ƶ�û��Ӱ�죬�����ʵ�Ũ�Ȳ��䣬��B����
C�������¶Ⱥ�������ѹǿ���䣬����1mol SO3�����ڵ�Чƽ��״̬��Ũ�Ȳ��䣬��D����
D�������¶ȣ�ƽ�����淴Ӧ�����ƶ���SO3��Ũ�ȼ�С����E����
E���ƶ�����ѹ�����壬�����С�������ʵ�Ũ�ȶ�����F��ȷ��
�ʴ�Ϊ����2.5 mol-1?L�� 0.02 mol?L-1?min-1�� ��AE����
��3��ԭ��ظ�������������Ӧ��SO2����������SO42-�������缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��CO��g��+NO2��g��?NO��g��+CO2��g����H=-akJ?mol-1��a��0��
��2CO��g��+2NO��g��?N2��g��+2CO2��g����H=-bkJ?mol-1��b��0��
�١�2+�ڵõ���4CO��g��+2NO2��g��?4CO2��g��+N2��g����H=-��2a+b��kJ?mol-1
��״���µ�3.36L CO�����ʵ����T
| 3.36L |
| 22.4L/mol |
| 0.15mol��(2a+b) |
| 4 |
| 3 |
| 80 |
�ʴ�Ϊ��NO2��
| 3(2a+b) |
| 80 |
��2����2SO2��g��+O2��g��?2SO3��g������H=-196kJ?mol-1����ʼʱ��10L���ܱ������м���4.0mol SO2��g����5.0mol O2��g����5���Ӻ�Ӧ�ﵽƽ�⣬���ų�����196kJ������SO2�����ʵ���Ϊ2mol�����ݻ�ѧƽ����ʽ���㣺
2SO2 +O2?2SO3��
��ʼ����mol�� 4.0 5.0 0
�仯����mol�� 2.0 1.0 2.0
ƽ������mol�� 2.0 4.0 2.0
K=
| [SO3]2 |
| [SO2]2?[O2] |
(
| ||||
(
|
v��O2��=
| ||
| 5min |
��A�������¶Ⱥ�����������䣬����2mol SO3��ƽ�����淴Ӧ�����ƶ�����SO2��O2��SO3����ƽ��Ũ�ȶ���ԭ������A��ȷ��
B�������¶Ⱥ�����������䣬����2mol N2����ƽ���ƶ�û��Ӱ�죬�����ʵ�Ũ�Ȳ��䣬��B����
C�������¶Ⱥ�������ѹǿ���䣬����1mol SO3�����ڵ�Чƽ��״̬��Ũ�Ȳ��䣬��D����
D�������¶ȣ�ƽ�����淴Ӧ�����ƶ���SO3��Ũ�ȼ�С����E����
E���ƶ�����ѹ�����壬�����С�������ʵ�Ũ�ȶ�����F��ȷ��
�ʴ�Ϊ����2.5 mol-1?L�� 0.02 mol?L-1?min-1�� ��AE����
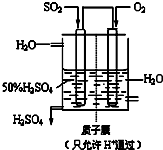
��3��ԭ��ظ�������������Ӧ��SO2����������SO42-�������缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��

��ϰ��ϵ�д�
 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
�����Ŀ