��Ŀ����
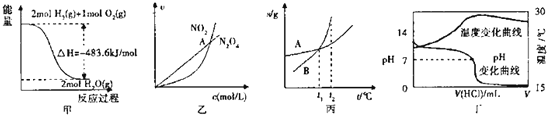
����Ŀ�����õ�FeSO4��Һ��ƣ�һ����Ϊ�Ƕ�����������Ϊ��������Ե�ʡ�ij�x��С��Ϊ�x����Һ��Fe2+��O2�����Ĺ��̣��������Ϸ��֣���Һ��Fe2+���������̷�Ϊ�Ⱥ�������������Fe2+ˮ�⣬����ˮ����ﱻO2����������С��ͬѧ�����о������²�ͬpH��Fe2+��O2������Ӱ�죬���ⶨ��Fe2+��������ʱ��仯�Ĺ�ϵ�������ͼ��
�ش��������⣺
��1��д��Fe2+ˮ������ӷ���ʽ___��Ҫ����FeSO4ˮ�⣬���Բ�ȡ�Ĵ�ʩ��___��
��2�������Ƶ�FeSO4��ҺŨ��Ϊ0.01mol/L����Ӧ��������Һ������䣬����ͼ��P��Fe2+����������___��
��3�������������£�Fe2+��O2�����ķ�Ӧ����ʽΪ��4Fe2++O2+4H+![]() 4Fe3++2H2O����֪�����¸÷�Ӧ��ƽ�ⳣ���ܴ�������˵����ȷ����___��
4Fe3++2H2O����֪�����¸÷�Ӧ��ƽ�ⳣ���ܴ�������˵����ȷ����___��
a.Fe2+ת��ΪFe3+�����ƺܴ�
b.Fe2+ת��ΪFe3+�����ʺܴ�
c.�÷�Ӧ���еú���ȫ
d.����������Fe2+���ᱻ����
��4�����ͼ������ͬpH��Fe2+��O2�����ķ�Ӧ������������Ӱ��___��
��5����K2Cr2O7����Һ�y����Һ��Fe2+Ũ�ȣ��Ӷ�����Fe2+�������ʡ���Ӧ���£�6Fe2++Cr2O72-+14H+��2Cr3++6Fe3++7H2O����ȡ20mL������Һ����0.0200mol��L1K2Cr2O7����Һ�ζ������ı���Һ16.50mL������Һ��c(Fe2+)=___mol��L1��
���𰸡�2Fe2++2H2O![]() 2Fe(OH)2+2H+ ��ϡH2SO4 1.6��10-4mol��(L��min)1 ac Fe2+������������pH������ӿ� 0.0990mol��L-1
2Fe(OH)2+2H+ ��ϡH2SO4 1.6��10-4mol��(L��min)1 ac Fe2+������������pH������ӿ� 0.0990mol��L-1
��������
(1)��������ˮ���������������������ӣ���Һ�����ԣ�����ˮ����Լ����Ӧ�
(2)����v=![]() ����Fe2+���������ʣ�
����Fe2+���������ʣ�
(3)�����¸÷�Ӧ��ƽ�ⳣ���ܴ�˵��Fe2+ת��ΪFe3+�����ƺܴ���Ӧ���ʲ�һ���ܴ÷�ӦΪ���淴Ӧ�������ܷ�Ӧ��ȫ�����ͼ����������������������ӱ����������
(4)���¶Ⱥ�����������ͬpHֵ��ͬʱ��pHֵԽ��Fe2+��������ԽС���Դ˽����⣻
(5)ȡ20mL������Һ����0.0200molL-1KCr2O7����Һ�ζ������ı���Һ16.50mL��������ӷ�Ӧ����ʽ�еĶ�����ϵ������Һ��c(Fe2+)��
(1)Fe2+����Һ��ˮ�����������������������ӣ�ˮ������ӷ���ʽ��2Fe2++2H2O![]() 2Fe(OH)2+2H+������������Ũ�ȣ�ƽ�������ƶ������ϡH2SO4������FeSO4ˮ�⣬�ʴ�Ϊ��2Fe2++2H2O
2Fe(OH)2+2H+������������Ũ�ȣ�ƽ�������ƶ������ϡH2SO4������FeSO4ˮ�⣬�ʴ�Ϊ��2Fe2++2H2O![]() 2Fe(OH)2+2H+����ϡH2SO4��
2Fe(OH)2+2H+����ϡH2SO4��
(2)��ͼ��֪��Fe2+Ũ�ȵı仯����0.01mol/L��40%=0.004mol/L����ͼ��P��Fe2+����������v=![]() =
=![]() =1.6��10-4mol��(L��min)1���ʴ�Ϊ��1.6��10-4mol��(L��min)1��
=1.6��10-4mol��(L��min)1���ʴ�Ϊ��1.6��10-4mol��(L��min)1��
(3)a.ƽ�ⳣ��Խ����Խ���ף�Fe2+ת��ΪFe3+�����ƺܴ�a��ȷ��b��ƽ�ⳣ��Խ��ʾ��Ӧ�ȴ���ʾFe2+ת��ΪFe3+�����ʺܴ�b����c��ƽ�ⳣ��Խ��ʾ��Ӧ�ȴ÷�Ӧ���еú���ȫ����c��ȷ��d��4Fe2++O2+4H+![]() 4Fe3++2H2O��ƽ�ⳣ���ܴ���������������Fe2+�ᱻ��������d����ac��ȷ���ʴ�Ϊ��ac��
4Fe3++2H2O��ƽ�ⳣ���ܴ���������������Fe2+�ᱻ��������d����ac��ȷ���ʴ�Ϊ��ac��
(4)���ݲ�ͬpH��Fe2+��O2��������ʱ��仯�Ĺ�ϵͼ����֪pHԽ����������Խ�죬����Fe2+������������pH������ӿ죬�ʴ�Ϊ��Fe2+������������pH������ӿ죻
(5)����Һ��c(Fe2+)=cmol��L-1���ɷ���ʽ�ɵ����й�ϵ��
6Fe2++Cr2O72-+14H+=2Cr3++6Fe3++7H2O
6 1
0.02L��c0.02mol��L-1��0.01650L
����0.02L��c��1=0.02mol��L-1��0.01650L��6�����c=0.0990mol��L-1���ʴ�Ϊ��0.0990mol��L-1��

����Ŀ��2009��10��1�գ��ҹ��ɹ��ٰ������ʮ���ı���������ı���ʽ��9���綯�����϶�����������Դ���������࣬չʾ���ۺϹ����������Ƽ���չˮƽ��ͬʱҲ˵����Դ��ȱ������������ٵ��ش����⡣�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��Ӧ�� CO(g) �� 2H2(g)![]() CH3OH(g) ��H1
CH3OH(g) ��H1
��Ӧ�� CO2(g) �� 3H2(g)![]() CH3OH(g) + H2O(g) ��H2
CH3OH(g) + H2O(g) ��H2
��������Ӧ������ԭ�Ӿ�����ԭ����� _____����������������������
���±����������Ƿ�Ӧ���ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
�¶� | 250�� | 300�� | 350�� |
K | 2.041 | 0.270 | 0.012 |
�ɱ��������ж���H1 0 ������������������������������
��ij�¶��£���2 mol CO��6 mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c(CO)�� 0.2 mol/L����CO��ת����Ϊ ����ʱ���¶�Ϊ �����ϱ���ѡ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) �� 3O2(g) �� 2CO2(g) �� 4H2O(g) ��H1����1275.6 kJ/mol
�� 2CO (g)+ O2(g) �� 2CO2(g) ��H2����566.0 kJ/mol
�� H2O(g) �� H2O(l) ��H3����44.0 kJ/mol
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ����
�������ͼ��ʾ�ĵ��װ�á��õ�������ĵ缫��ӦΪ ��

�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��
����Ŀ����ij�¶��£���������ʼ���Ϊ1L���ܱ������а�����ʾͶ�ϣ�������ӦN2(g)+3H2(g)2NH3(g)��H<0���ﵽƽ��ʱ������˵���������
������� | �������� | ��ʼ���ʵ��� | ��Ӧ���ת���� | ƽʱʱ | ||
|
|
| ||||
�� | ���º��� | 1 | 3 | 0 |
|
|
�� | ���Ⱥ��� | 0 | 0 | 2 |
| a |
�� | ���º�ѹ | 1 | 3 | 0 |
| b |
A.ƽ��ʱNH3�����ʵ�����a>1.2��b>1.2
B.����I��II��ƽ�ⳣ����ϵ��K(I)>K(II)
C.a1+a2<1
D.����ʼʱ������A�г���lmolN2(g)��0.4molH2(g)��0.4molNH3(g)����ʱƽ��������Ӧ�����ƶ�