题目内容
(14分)已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加。其中A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外);E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满。请根据以上信息,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)

(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为 ;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为 。
(4)E核外电子排布式是 ,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有

(1)A、B、C、D四种元素电负性由大到小排列顺序为
(2)C形成的晶体中,其微粒堆积方式为 ;
(3)D单质的熔点很高,可用作计算机的核心部件,但会被氢氧化钠溶液腐蚀,其腐蚀的离子方程式为: ;D的氧化物在通讯方面有重要用途,90克D的氧化物中含共价键的数目为 。
(4)E核外电子排布式是 ,E的某种化合物的结构如图所示,则此化合物中各种粒子间的相互作用力有
(1)N ﹥ C ﹥ Si ﹥ Na
(2)体心立方堆积
(3)Si + 2OH-+H2O ="=" SiO32-+ 2H2↑ 6NA
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1)
离子键、共价键、配位键、氢键(每个1分,共4分)
(2)体心立方堆积
(3)Si + 2OH-+H2O ="=" SiO32-+ 2H2↑ 6NA
(4)1s22s22p63s23p63d104s1(或[Ar] 3d104s1)
离子键、共价键、配位键、氢键(每个1分,共4分)
A与B 、A与D在周期表中位置相邻,A原子核外有两个未成对电子,A为碳,B元素的第一电离能比同周期相邻两个元素都大,C原子在同周期原子中半径最大(稀有气体除外),B为氮,C为钠,D为硅,又E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满,E为铜。
(1)A、B、C、D四种元素电负性由大到小排列顺序为N ﹥ C ﹥ Si ﹥ Na
(2)C形成的晶体是钠,其微粒堆积方式为体心立方堆积。
(3)Si + 2OH-+H2O ="=" SiO32-+ 2H2↑
90克D的氧化物中含共价键的数目:(90g/60g·mol-1)×4 Na=6Na
(4)E为铜,核外电子排布式是1s22s22p63s23p63d104s1(或[Ar] 3d104s1),化合物中各种粒子间的相互作用力有离子键、共价键、配位键、氢键。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目


 杂化,其键角比水分子 (填“大”或“小”)。
杂化,其键角比水分子 (填“大”或“小”)。
 氢键的“键能”)是 kJ / mol 。
氢键的“键能”)是 kJ / mol 。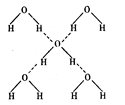
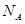 表示阿伏加德罗常数,则CaO晶胞体积为 cm3。
表示阿伏加德罗常数,则CaO晶胞体积为 cm3。