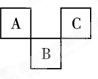
题目内容
短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是
A.原子半径A<B<C B.A的氢化物的稳定性大于C的氢化物的稳定性
C.C的氧化物的熔点比A的氧化物的低 D.A与C可形成离子化合物
B
解析试题分析:根据题意可得A是C;B是Mg;C是Si。A.原子核外的电子层数越多,原子半径就越大。当原子核外电子层数相同时,原子序数越大,原子半径就越小。因此原子半径:Mg> Si >C。错误。B.元素的非金属性越强,其氢化物的稳定性就越强。元素的非金属性C>Si,所以稳定性CH4>SiH4。C.C的氧化物SiO2是原子晶体,原子间通过共用电子对结合,结合力强,断裂难,素养熔点高,而A的氧化物CO2属于分子晶体,分子之间通过分子间作用力结合,分子间作用力是一种很弱的作用力,所以破坏溶液,因此熔点低,在室温下CO2是气体。错误。D.A与C可形成的化合物SiC是共价化合物。错误 。
考点:考查元素的推断、元素及形成的化合物的性质的知识。

短周期元素R、T、Q、W、Z在元素周期表中的相对位置如下图所示,五种元素中只有一种金属元素。下列判断错误的是( )
| | | R | | |
| T | Q | | W | Z |
A.W的单质易溶于CS2
B.Q与R可能形成化合物Q3R4
C.T的最高价氧化物的对应水化物为强碱
D.W、Z都有多种含氧酸
已知锂和镁在元素周期表中有特殊“对角线”关系,它们的性质非常相似。下列有关锂及其化合物叙述正确的是( )
| A.Li2SO4难溶于水 | B.Li与N2反应产物是Li3N |
| C.LiOH易溶于水 | D.LiOH与Li2CO3受热都很难分解 |
下列各种说法中,正确的是 ( )
| A.3号到9号元素化合价的变化与11到17号元素化合价的变化完全相同 |
| B.同周期原子半径逐渐减小,所以离子半径也逐渐减小 |
| C.随着原子序数的递增,碱金属元素单质的还原性逐渐增强,阳离子的氧化性逐渐减弱 |
| D.甲乙电子层数相同,甲的最高价氢氧化物的碱性比乙的最高价氢氧化物的碱性强,说明甲的核电荷数比乙大 |
已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高1万倍,将CD缩减到1英寸……,下列有关氮化镓的说法中正确的是 ( )
| A.氮化镓是由主族元素与副族元素形成的化合物 | B.氮化镓能把白铁变成黄金 |
| C.氮化镓中氮元素显+3价 | D.氮原子最外层比镓原子最外层多2个电子 |
下列叙述中,金属a的活泼性肯定比金属b的活泼性强的是 ( )
| A.a原子的最外层电子数比B原子的最外层电子数少 |
| B.a原子电子层数比b原子的电子层数多 |
| C.1mol a 从酸中置换H+生成的H2比b从酸中置换H+生成的H2 要容易 |
| D.常温时,b能从水中置换出氢,而a不能 |
X、Y、Z、Q、W均为短周期元素,原子序数逐渐增大。X、Q同主族,Q元素的焰色反应为黄 色;W的原子半径是同周期中最小的;X与Y、Z分别形成化合物甲、乙,甲、乙均由10电子分子构成,且能反应生成碱。下列说法不正确的是
| A.X的单质和Q的单质均可用电解法制得 |
| B.X与Z可形成同时含有极性键和非极性键的化合物 |
| C.Q与W形成的化合物熔化或溶于水时均可发生电离 |
| D.X、Y、Z三种元素形成的化合物一定能抑制水的电离 |
原子序数依次增大的短周期主族元素W、X、Y、Z和M中,W的最外层电子数为其周期数的二倍;X和Z的A2B型氢化物均为V形分子,Y的+1价离子比M的-1价离子少8个电子,根据以上叙述,下列说法中正确的是
| A.上述五种元素的原子半径大小为W<X<Y<Z<M |
| B.由这些元素形成的三原子分子中,空间结构为直线形的有WX2、WZ2、ZX2 |
| C.元素W与氢形成的原子个数比为1?1的化合物有很多种 |
| D.X与Y可形成含有非极性共价键的共价化合物 |