题目内容
已知镓和铝在周期表中位于同一纵行,氮化镓可把手机信号扩大10倍,让电脑的速度提高1万倍,将CD缩减到1英寸……,下列有关氮化镓的说法中正确的是 ( )
| A.氮化镓是由主族元素与副族元素形成的化合物 | B.氮化镓能把白铁变成黄金 |
| C.氮化镓中氮元素显+3价 | D.氮原子最外层比镓原子最外层多2个电子 |
D
解析试题分析:A.N、Ga都是主族元素,因此氮化镓完全是由主族元素形成的化合物。错误。B.根据题意元素形成新的物质,会使物质增值很多,但是也要化学反应的过程就是原子重新组合的过程。所以从化学角度看白铁不可能变成黄金。错误。C.在化合物中正负化合价的代数和为0.由于非金属性N>Ga.所以在氮化镓中氮元素显-3价。错误。D.氮原子最外层有5个电子,而镓原子最外层有3个电子,因此N比Ga最外层多2个电子。正确。
考点:考查元素在周期表中的物质及与结构、性质的关系的知识。

练习册系列答案
相关题目
元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是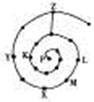
| A.L、M、X三元素位于同一族 |
| B.K、Z两元素的氢化物的水溶液都显酸性 |
| C.Y元素对应的氢化物比K元素对应的氢化物沸点低 |
| D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3- |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | M | R | Q | |
| 原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +5 | —— |
| 最低负价 | —— | -1 | —— | —— | -3 | -2 | |
A.元素X和Q形成的化合物中不可能含有共价键
B.X、Z、R的最高价氧化物的水化物之间可两两相互反应
C.R3-比Q2-更容易失去电子
D.M(OH)2的碱性比XOH的碱性强
最近医学界通过放射性14C来标记C60的羧酸衍生物在特定条件下通过断裂DNA来杀死细胞,从而抑制艾滋病(AIDS),有关14C的叙述正确的是 ( )
| A.与C60中普通碳原子的化学性质不同 | B.与12C互为同位素 |
| C.与14N含的中子数相同 | D.是C60的同素异形体 |
短周期元素Q、R、T、W在元素周期表中的位置如下,其中T原子的M层电子数比K层多2个,下列叙述不正确的是 ( )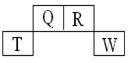
| A.H2R2的分子中既含有极性共价键,又含有非极性共价键 |
| B.Q、R的简单氢化物分子所含质子数、电子数与Ne分子相同 |
| C.T的氧化物是一种良好的半导体材料 |
| D.Q的氢化物与W的氢化物反应有白烟现象,且生成物中既含有离子键,又含有共价键 |
2012年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素, 该同位素原子的质量数为298。以下叙述正确的是( )
| A.该元素属于第六周期 |
| B.该元素位于第ⅢA族 |
| C.该元素为金属元素,性质与82Pb相似 |
| D.该同位素原子含有114个电子,185个中子 |
下列说法中错误的是
| A.SO2、SO3都是极性分子 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
下列说法正确的是
| A.第三周期金属元素的氧化物都属于碱性氧化物 |
| B.电子层结构相同的不同离子,其半径随核电荷数增大而减小 |
| C.IA族元素的金属性一定比IIA族元素的金属性强 |
| D.单原子形成的离子,一定与稀有气体原子的核外电子排布相同 |