题目内容
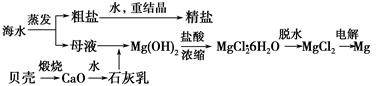
蓝铜矿主要含xCuCO3·yCu(OH)2,还含有少量Fe的化合物,工业上以蓝铜矿为原料制备Cu、CaCO3和CuSO4.5H2O。具体方法步骤如下:
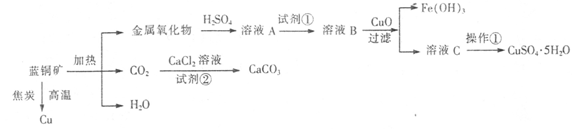
已知:
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式
。
(2)从下列所给试剂中选择:实验步骤中试剂①为 (填代号)。
a.KMnO4 b.K2Cr2O7 c.H2O2 d.氯水
(3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至 时停止加热。
(5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是
(填代号);
a.氨水 b.盐酸 c.水蒸气 d.NaOH溶液
如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因 。
(6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为 。

已知:
| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀 | 3.2 | 9.0 | 6.7 | |
(1)蓝铜矿的主要成分与焦炭高温条件可以生成铜、二氧化碳和水,写出该反应的化学方程式
。
(2)从下列所给试剂中选择:实验步骤中试剂①为 (填代号)。
a.KMnO4 b.K2Cr2O7 c.H2O2 d.氯水
(3)在溶液B中加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuSO4.5H2O,需要经过加热蒸发浓缩、冷却结晶、过滤等操作,加热蒸发至 时停止加热。
(5)制备CaCO3时,应向CaCl2溶液中先通人(或加入)试剂②,则试剂②可以是
(填代号);
a.氨水 b.盐酸 c.水蒸气 d.NaOH溶液
如果不加人试剂②,则CaCl2溶液不能与CO2反应生成CaCO3,请依据难溶电解质的沉淀溶解平衡原理分析可能的原因 。
(6)为确定试剂①的用量,需测定溶液A中Fe2+的浓度。实验操作为:准确量取20.00mL 溶液A于锥形瓶中,用0.01200 mol/L的酸性KMnO4标准溶液滴定至终点,消耗KMnO4标准溶液15.00 mL,则溶液A中Fe2+的浓度为 。
(1)2[xCuCO3·yCu(OH)2] + (x+y)C ="==" 2(x+y)Cu + (3x+y)CO2 + 2yH2O ( 2分)
(2)c (2分)
(3)3.2≤pH<4.7 (2分)
(4)有少量晶体析出(或者表面出现结晶薄膜) (2分)
(5) ad (2分) H2CO3第二步电离产生的CO32-离子浓度太低,与Ca2+浓度的乘积小于CaCO3的溶度积,因而不能生成CaCO3沉淀。加入碱性物质后CO32-离子浓度增大,与Ca2+浓度的乘积超过了CaCO3的溶度积,因而能生成CaCO3沉淀。(合理即可,2分)
(6) 0.04500mol/L (2分,有效数字错误扣1分)
试题分析:⑵双氧水是一种绿色氧化剂,不会引进杂质,因此选C。⑶加入CuO是调节溶液的pH,目的是除去溶液中的三价铁离子,而不能让铜离子沉淀,因此酸碱度应控制在3.2≤pH<4.7。⑷要利用余热将剩余的水分蒸干。⑸先要使溶液显碱性,氯化钙溶液中通入二氧化碳才能生成碳酸钙沉淀。
⑹ KMnO4~~~~~~~~~~5Fe2+
1mol 5mol
0.01200 mol/L×15.00 mL c(Fe2+)·20.00mL
解之得:c(Fe2+)=0.04500mol/L

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目



 )
)