题目内容
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是_________________________________________。
(2)H2O2分解的化学方程式为________________________。
(3)实验①和②的目的是_______________________________________________________。
实验时由于没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是______________________________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如下图:
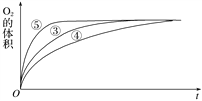
分析上图能够得出的实验结论是_______________________________________________。
【答案】 降低了反应的活化能 2H2O2![]() 2H2O+O2↑ 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂 (或将盛有反应物的试管放入同一热水浴中) 碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
2H2O+O2↑ 探究浓度对反应速率的影响 向反应物中加入等量同种催化剂 (或将盛有反应物的试管放入同一热水浴中) 碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率
【解析】(1)由于催化剂改变反应的途径,降低反应所需的活化能,从而加快反应速率;(2)H2O2分解的化学方程式为2H2O2![]() 2H2O+O2↑;(3)实验①10mL2% H2O2溶液,实验②10mL5% H2O2溶液,两者中双氧水的浓度不同,所以实验的目的是则该实验的目的为探究浓度对化学反应速率的影响;对原实验方案的改进是:向反应物中加入等量同种催化剂 (或将盛有反应物的试管放入同一热水浴中)。(4)实验③、④、⑤中不同的是溶液的酸碱性,由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。
2H2O+O2↑;(3)实验①10mL2% H2O2溶液,实验②10mL5% H2O2溶液,两者中双氧水的浓度不同,所以实验的目的是则该实验的目的为探究浓度对化学反应速率的影响;对原实验方案的改进是:向反应物中加入等量同种催化剂 (或将盛有反应物的试管放入同一热水浴中)。(4)实验③、④、⑤中不同的是溶液的酸碱性,由图可知,⑤的反应速率最大,④的反应速率最小,结合实验方案可知,碱性环境能增大H2O2分解的速率,酸性环境能减小H2O2分解的速率。

 智慧小复习系列答案
智慧小复习系列答案