题目内容
【题目】常温下,将NaOH溶液滴加到某一元酸(HA)溶液中,测得混合溶液的pH与离子浓度变化关系如下图所示【已知:P[c(A-)/c(HA)]=-1g[c(A-)/c(HA)]】。下列叙述不正确的是
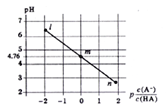
A. Ka(HA)的数量级为10-5
B. 滴加NaOH溶液过程中,c(A-)/[c(HA)×c(OH-)]保持不变
C. m点所示溶液中:c(H+)=c(HA)+c(OH-)-c(Na+)
D. n点所示溶液中:c(Na+)=c(A-)+c(HA)
【答案】D
【解析】A. Ka(HA)=  ,根据图像,P[c(A-)/c(HA)]=-1g[c(A-)/c(HA)]=0时,
,根据图像,P[c(A-)/c(HA)]=-1g[c(A-)/c(HA)]=0时, 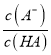 =1,pH=4.76,即Ka(HA)=10-4.76,数量级为10-5,故A正确;B. 滴加NaOH溶液过程中,
=1,pH=4.76,即Ka(HA)=10-4.76,数量级为10-5,故A正确;B. 滴加NaOH溶液过程中,  =
=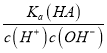 =
=![]() ,温度不变,HA的电离平衡常数和水的离子积常数均不变,因此
,温度不变,HA的电离平衡常数和水的离子积常数均不变,因此![]() 保持不变,故B正确;C. m点所示溶液中
保持不变,故B正确;C. m点所示溶液中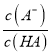 =1,根据电荷守恒:c(Na+)+ c(H+) =c(A-)+ c(OH-),则c(H+)= c(A-)+c(OH-)-c(Na+)= c(HA)+c(OH-)-c(Na+),故C正确;D. n点所示溶液显酸性,为HA和NaA的混合溶液,根据物料守恒,c(Na+)<c(A-)+c(HA),故D错误;故选D。
=1,根据电荷守恒:c(Na+)+ c(H+) =c(A-)+ c(OH-),则c(H+)= c(A-)+c(OH-)-c(Na+)= c(HA)+c(OH-)-c(Na+),故C正确;D. n点所示溶液显酸性,为HA和NaA的混合溶液,根据物料守恒,c(Na+)<c(A-)+c(HA),故D错误;故选D。

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
【题目】为提纯下列物质(括号内为杂质),所用的除杂试剂和分离方法都正确的是
序号 | 不纯物 | 除杂试剂 | 分离方法 |
A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
B | 苯(Br2) | NaOH溶液 | 过滤 |
C | C2H5OH(乙酸) | 新制生石灰 | 蒸馏 |
D | 乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 蒸馏 |
A.AB.BC.CD.D