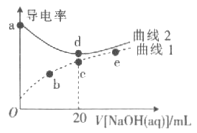
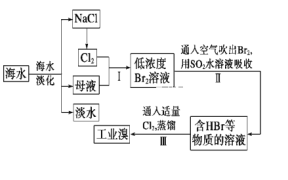
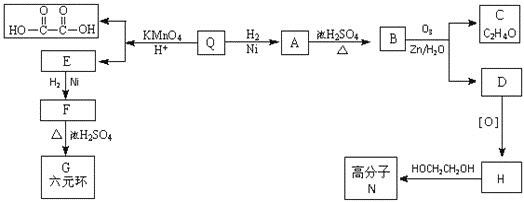
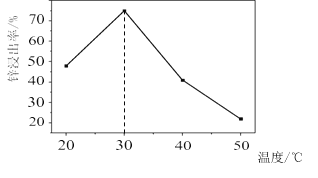
题目内容
【题目】图装置中,U型管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是
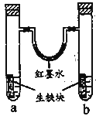
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:![]()
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
【答案】B
【解析】
A. 生铁块在电解质溶液中形成了原电池,铁活泼,作原电池的负极,碳不活泼作原电池的正极,A正确;
B. a试管中盛饱和食盐水,发生吸氧腐蚀,氧气消耗,气压变低,b试管中放氯化铵溶液,发生析氢腐蚀,产生氢气,气压增大红墨水柱两边的液面变为左高右低,B错误;
C. 不管是析氢腐蚀还是吸氧腐蚀,作为原电池的负极,铁都失去电子变成亚铁离子,两试管中相同的电极反应式是:![]() ,C正确;
,C正确;
D. a试管中饱和食盐水溶液呈中性发生了吸氧腐蚀,b试管中氯化铵溶液呈酸性,发生了析氢腐蚀,D正确;
答案选B。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】莫尔法是一种沉淀滴定法,以K2CrO4为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
银盐 性质 | AgCl | AgBr | Ag2CrO4 |
颜色 | 白 | 浅黄 | 砖红 |
滴定终点的现象是______,终点现象对应的离子反应方程式为______。为了测定产品中(NH4)2Cr2O7的含量,称取样品0.1500g,置于锥形瓶中,加50mL水,再加入2g KI(过量)及稍过量的稀硫酸溶液,摇匀,暗处放置10min,然后加150mL蒸馏水并加入3mL 0.5%淀粉溶液,用0.1000mol/L Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液30.00mL,则上述产品中(NH4)2Cr2O7的纯度为______。(假定杂质不参加反应,已知:①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,I2+2S2O32-=2I-+S4O62-;②(NH4)2Cr2O7的摩尔质量为252g/mol)。