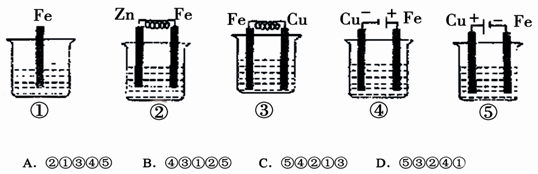
题目内容
结合下图判断,下列叙述正确的是
| A.I和Ⅱ中正极均被保护 |
| B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
A
解析试题分析:A、题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护;故A对;B、I中的负极反应式为:Zn-2e-=Zn2+,而II中负极是铁,反应式为:Fe-2e-=Fe2+,故B错;C、I溶液显中性,其电极反应式为:O2+2H2O+4e-=4OH-,而II溶液显酸性,电极反应式为:2H++2e-=H2↑,故C错;D、I中没有Fe2+,不能与K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,故D错;故选A.
考点:原电池的工作原理以及金属的腐蚀及防护

练习册系列答案
相关题目
A1-H2O2电池功率大,可作为许多机械的动力电池,其结构如图所示。下列说法不正确的是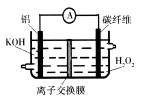
| A.铝作负极,电池工作时将不断溶解 |
| B.该电池不是二次电池,不可充电 |
| C.碳纤维电极的电极反应是H2O2+2 e一+2H+ =" 2" H2O |
| D.电池工作时OH一从碳纤维电极透过离子交换膜移向Al电极 |
如图为阳离子交换膜法电解饱和食盐水原理示意图,其中的阳离子交换膜仅允许Na+通过。下列说法错误的是
A.a极的电极反应式为:2 H++ 2 e H2 ↑ H2 ↑ |
| B.D口导出的是NaOH溶液 |
| C.浓盐水从A口注入 |
| D.C口导出的是NaOH和NaCl的混合溶液 |
如图为用酸性氢氧燃料电池为电源进行电解的实验装置示意图。下列说法中,正确的是
| A.燃料电池工作时,正极反应为:O2 + 4H++ 4e-= 2H2O |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是含锌、铁的粗铜,b极是纯铜,a极溶解铜的质量与b极析出铜的质量相等 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
关于下列装置说法正确的是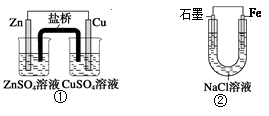
| A.装置①中,盐桥中的K+移向CuSO4溶液 |
| B.装置①中,Zn为负极,发生还原反应 |
| C.装置②中的Fe发生析氢腐蚀 |
| D.装置②中电子由Fe流向石墨,然后再经溶液流向Fe |
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液。放电时两个电极反应分别为:Zn+2OH-=Zn(OH)2 +2e-; Ag2O +H2O +2e- ="2Ag" +2OH-。下列说法错误的是
| A.溶液中OH-向正极移动 | B.锌发生氧化反应 |
| C.氧化银是正极 | D.在电池放电过程中,电解质溶液的碱性增强 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。以下说法正确的是 ( )。
| A.电池工作时,MnO2失去电子 |
| B.电池工作时,电子由锌经外电路流向MnO2 |
| C.从反应方程式来看,不使用氢氧化钾,也不影响电流大小 |
| D.电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq) |