题目内容
【题目】工业生产中产生的SO2、NO直接排放将对大气造成严重污染.利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素).

请回答下列问题.
(1)装置Ⅱ中NO在酸性条件下生成NO2-的离子方程式__________________;
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如图1所示

①下列说法正确的是 (填标号)。
A.pH=7时,溶液中c( Na+)<c (HSO3-)+c(SO32-)
B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7
C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜
D.pH=9时溶液中c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3)
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的总离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ 的作用之一是再生Ce4+ ,其原理如下图所示。
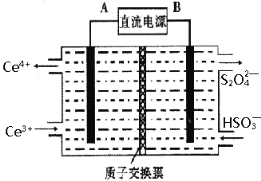
图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4) 已知进入装置Ⅳ的溶液中NO-2的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO-2完全转化为 NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
【答案】(1)H2O + NO + Ce4+ = 2H+ + NO2- + Ce3+(2)①BCD;②3SO2 + 5OH- = 2SO32- + HSO3- + 2H2O;③酸式;当滴入最后一滴高锰酸钾溶液,溶液由无色变为浅红色,且半分钟不褪色。(3)正;2H+ + 2HSO3- + 2e- = S2O42- + 2H2O(4)4480L
【解析】
试题分析:装置Ⅰ中二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应,装置Ⅱ中NO在酸性条件下,NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,装置Ⅲ中,在电解槽的阳极2Ce3+-2e-=2Ce4+,阴极电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,装置Ⅳ中通入氨气、氧气,2NO2-+O2++2H++2NH3=2NH4++2NO3-,
(1)装置Ⅱ中NO在酸性条件下NO和Ce4+之间会发生氧化还原反应:NO+H2O+Ce4+=Ce3++NO2-+2H+,NO+2H2O+3Ce4+=3Ce3++NO3-+4H+,故答案为:NO+H2O+Ce4+=Ce3++NO2-+2H+;
(2)①A、pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故A错误;B、HSO3-![]() SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;C、溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;D、pH=9时溶液,溶液为亚硫酸钠溶液,由质子守恒可知,c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3),故D正确;故答案为:BCD;
SO32-+H+,由图中数据,pH=7时,c(HSO3- )=c(SO32- ),由Ka的表达式可知,H2SO3的第二级电离平衡常数K2≈c(H+)=10-7,故B正确;C、溶液的pH控制在4~5时,c(HSO3- )浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;D、pH=9时溶液,溶液为亚硫酸钠溶液,由质子守恒可知,c(OH-)=c(H+)+c(HSO3-)+2c(H2SO3),故D正确;故答案为:BCD;
②1L1.0mol/L的NaOH溶液中含有氢氧化钠的物质的量为:1L×1.0mol/L=1.0mol,13.44L(标况下)SO2,n(SO2)=![]() =0.6mol,
=0.6mol,
设反应生成亚硫酸钠的物质的量为x,消耗二氧化硫的物质的量为y
2NaOH+SO2═Na2SO3+H2O
2 1 1
1.0mol y x
![]() =
=![]() =
=![]() 解得:x=0.5mol y=0.5mol根据上述计算可以知道,二氧化硫是过量的,剩余的二氧化硫的物质的量为:0.6mol-0.5mol=0.1mol
解得:x=0.5mol y=0.5mol根据上述计算可以知道,二氧化硫是过量的,剩余的二氧化硫的物质的量为:0.6mol-0.5mol=0.1mol
所以二氧化硫会和生成的亚硫酸钠继续反应,
设消耗亚硫酸钠的物质的量为a,生成亚硫酸氢钠的物质的量为b
Na2SO3+H2O+SO2═2NaHSO3
1 1 2
a 0.1mol b
![]() =
=![]() =
=![]() ,解得:a=0.1mol b=0.2mol,
,解得:a=0.1mol b=0.2mol,
则溶液中n(SO32-)=0.5mol-0.1mol=0.4mol,n(HSO3-)=0.2mol,n(SO32-):n(HSO3-)=2:1,则反应的离子方程式为3SO2+5OH-=2SO32-+HSO3-+2H2O,
故答案为:3SO2+5OH-=2SO32-+HSO3-+2H2O;
③酸式滴定管只能盛放酸性溶液、碱式滴定管只能盛放碱性溶液,酸性高锰酸钾溶液呈酸性,则可以盛放在酸式滴定管中;原溶液无色,而KMnO4为紫红色,所以当溶液中的H2C2O4和KHC2O4反应完全时,滴入最后一滴溶液呈紫红色且半分钟颜色不变;故答案为:酸式;滴入最后一滴溶液呈紫红色且半分钟颜色不变;
(3)生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,连接电源正极,反应物是HSO3-被还原成S2O42-,得到电子,电极反应式为:2HSO3-+2H++2e-=S2O42-+2H2O,故答案为:正;2HSO3-+2H++2e-=S2O42-+2H2O;
(4)NO2-的浓度为0.4mol/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,则失去电子数为:1000×(5-3)×0.4mol,设消耗标况下氧气的体积是V,根据电子守恒:![]() ×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480。
×4=1000×(5-3)×0.4mol,解得V=4480L,故答案为:4480。