题目内容
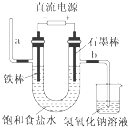
【题目】工业上常利用含硫废水生产Na2S2O35H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程.
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)装置A中发生的化学反应方程式为
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为 .
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是 .
(4)已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是 , 装置E的作用为
(5)反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O35H2O,其中可能含有Na2SO3、Na2SO4等杂质.利用所给试剂设计实验,检测产品中是否存在Na2SO4 , 简要说明实验操作,现象和结论: . 已知:Na2S2O35H2O遇酸易分解:S2O32+2H+=S↓+SO2↑+H2O供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液.
【答案】
(1)Na2SO3+H2SO4═Na2SO4+SO2↑+H2O
(2)2:1
(3)c;控制滴加硫酸的速度
(4)溶液变澄清(或混浊消失);吸收SO2防止污染空气
(5)取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质
【解析】解:(1)根据装置图可知,A中的反应为浓硫酸与亚硫酸钠反应生成二氧化硫,反应的化学方程式为:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O,所以答案是:Na2SO3+H2SO4═Na2SO4+SO2↑+H2O;(2)C中Na2S和Na2SO3恰好完全反应,由Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)(Ⅰ)2H2S(aq)+SO2(g)═3S(s)+2H2O(l)(Ⅱ)S(g)+Na2SO3(aq) ![]() Na2S2O3(aq)(Ⅲ)可知,(Ⅰ)×2+(Ⅱ)+(Ⅲ)×3,得到总反应为2Na2S(aq)+Na2SO3(aq)+3SO2(g)
Na2S2O3(aq)(Ⅲ)可知,(Ⅰ)×2+(Ⅱ)+(Ⅲ)×3,得到总反应为2Na2S(aq)+Na2SO3(aq)+3SO2(g) ![]() 3Na2S2O3(aq),则C中Na2S和Na2SO3物质的量之比为2:1,所以答案是:2:1;(3)观察SO2的生成速率,发生强酸制取弱酸的反应,a不生成二氧化硫,bd中物质均与二氧化硫反应,只有c中饱和NaHSO3溶液适合制取二氧化硫,通过控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,所以答案是:c;控制滴加硫酸的速度;(4)根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),反应尾气中有未反应的二氧化硫气体,会污染空气,所以要用E装置吸收SO2防止污染空气,所以答案是:溶液变澄清(或混浊消失);吸收SO2防止污染空气;(5)检测产品中是否存在Na2SO4 , 操作、现象和结论为取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质,所以答案是:取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质.
3Na2S2O3(aq),则C中Na2S和Na2SO3物质的量之比为2:1,所以答案是:2:1;(3)观察SO2的生成速率,发生强酸制取弱酸的反应,a不生成二氧化硫,bd中物质均与二氧化硫反应,只有c中饱和NaHSO3溶液适合制取二氧化硫,通过控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,所以答案是:c;控制滴加硫酸的速度;(4)根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液变澄清(或混浊消失),反应尾气中有未反应的二氧化硫气体,会污染空气,所以要用E装置吸收SO2防止污染空气,所以答案是:溶液变澄清(或混浊消失);吸收SO2防止污染空气;(5)检测产品中是否存在Na2SO4 , 操作、现象和结论为取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质,所以答案是:取少量产品溶于足量稀盐酸中,静置,取上层清液(或过滤后取滤液),滴加BaCl2溶液,若出现白色沉淀则说明含有Na2SO4杂质.