题目内容
【题目】实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL:
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④摇匀 ⑤移液 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为____________________。
(2)本实验用到的玻璃仪器有________________(至少回答3个)。
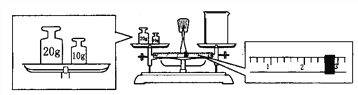
(3) 某同学欲称量NaOH的质量,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为________g,要完成本实验该同学应称出______g NaOH。
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是_____(填序号)
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线。
【答案】 ②①③⑧⑤⑥⑦④ 烧杯、玻璃棒、250ml容量瓶、量筒、胶头滴管 27.4 10.0 ④
【解析】(1). 配制一定物质的量浓度溶液的一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,所以正确的顺序为:②①③⑧⑤⑥⑦④;
(2).根据实验操作的步骤以及每步操作需要的仪器主要有:一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线12cm时,改用胶头滴管滴加,所以需要的玻璃仪器为:烧杯、玻璃棒、250mL容量瓶、胶头滴管、量筒等。
故答案为:烧杯、玻璃棒、250mL容量瓶、胶头滴管、量筒等(回答三个即可);
(3). 根据天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为30g-2.6g = 27.4g,因配制溶液的体积为240mL,而容量瓶的规格没有240mL,故只能选用250mL的容量瓶,则NaOH的质量m=cvM=1.0mol·L1×0.25L×40g/mol=10.0g,故答案为:27.4;10.0;
(4). ①没有洗涤烧杯和玻璃棒,会导致溶质的物质的量偏小,溶液浓度偏低,故①不选;②转移溶液时不慎有少量洒到容量瓶外面,导致溶质的物质的量偏小,溶液浓度偏低,故②不选;③容量瓶不干燥,含有少量蒸馏水,因后续还需要加水定容,故对所配制的溶液浓度无影响,故③不选;④定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故④正确;⑤定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故⑤不选。所以答案选④。

 阅读快车系列答案
阅读快车系列答案【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

(1)金属M为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)CoC2O4﹒2H2O高温焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其目的是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
![]()
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | 69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | —— | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。
已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
① 沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:____________________。
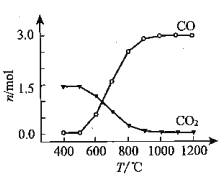
② 氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH_____0(填“>”“<”或“=”),判断依据:_______________。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是__________________________。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有_____________。
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下:
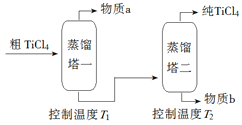
物质a是______________,T2应控制在_________。