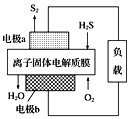
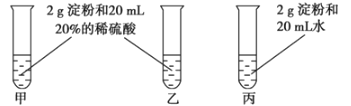
题目内容
【题目】室温时,H2S 的 Ka1 =1.0 ×10-7,Ka2 =1.0 ×10-15下列说法正确的是
A.0.1 mol L-1的 NaHS溶液中:c(S2ˉ)>c(H2S)
B.反应 S2ˉ+ H2O ![]() HSˉ+ OHˉ 的平衡常数 K=1×10-7
HSˉ+ OHˉ 的平衡常数 K=1×10-7
C.NaHS与 Na2S以任意比混合的溶液中 :c( Na+)+ c(H+)=c(HSˉ)+ c(S2ˉ)+c(OHˉ)
D.0.1 mol L-1的Na2S 溶液中:c(OHˉ)= c(H+)+ c(HSˉ) + 2c(H2S)
【答案】D
【解析】
A.HSˉ的水解平衡常数Kh= =1×10-7= Ka1 ,所以HSˉ的电离程度和水解程度相同,HSˉ电离产生S2ˉ,水解产生H2S,所以c(S2-)=c(H2S),故A错误;
=1×10-7= Ka1 ,所以HSˉ的电离程度和水解程度相同,HSˉ电离产生S2ˉ,水解产生H2S,所以c(S2-)=c(H2S),故A错误;
B.反应 S2ˉ+ H2O ![]() HSˉ + OHˉ 的平衡常数 K=
HSˉ + OHˉ 的平衡常数 K=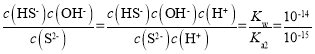 =10,故B错误;
=10,故B错误;
C.NaHS与Na2S以任意比混合的溶液中存在电荷守恒:c(Na+)+ c(H+)=c(HSˉ)+ 2c(S2ˉ)+c(OHˉ),故C错误;
D.0.1 mol L-1的Na2S 溶液中存在电荷守恒c(Na+)+ c(H+)=c(HSˉ)+ 2c(S2ˉ)+c(OHˉ),存在物料守恒c(Na+)= 2c(HSˉ)+ 2c(S2ˉ)+2c(H2S),二者联立可得c(OH-)= c(H+)+ c(HS-) + 2c(H2S),故D正确;
故答案为D。

 名校课堂系列答案
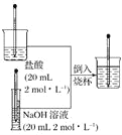
名校课堂系列答案【题目】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的化学试剂。欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为_____。
(2)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_________。
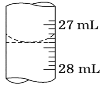
(3)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50 mL,滴定后液面如图,则此时消耗标准溶液的体积为_____。
乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.11 | 25.10 |
2 | 25.00 | 1.56 | 33.30 |
3 | 25.00 | 0.21 | 25.22 |
(4)选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为______(保留四位有效数字)。
(5)下列哪些操作会使测定结果偏高_____ (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(6)滴定达到终点的标志是________。
【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |
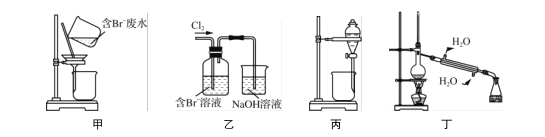
下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2