题目内容
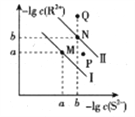
【题目】常温下,向25.00mL 0.1mol·L-1 HSCN溶液中滴入0.1 mol·L-1 NaOH溶液,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法正确的是( )

A. 常温下,Ka(HSCN)约为1×10-3
B. N点溶液中:c(Na+)<c(SCN-)
C. R、Q两点溶液对应的[H+]都为10-7
D. b=25.00
【答案】D
【解析】
A. 根据题图知,0.1mol·L-1 HSCN溶液中-1gc水(H+)=11,则c水(H+)=10-11mol/L,故溶液中c(H+)=10-3mol/L,则Ka(HSCN)=![]() =1×10-5,故A错误;
=1×10-5,故A错误;
B. -1gc水(H+)越小,水的电离出的越大。N点是水的电离程度最大的点,此时溶液是NaSCN溶液,酸与碱恰好反应,SCN-水解,则所得溶液呈碱性,c(OH-)>c(H+),根据电荷守恒可知c(Na+)+c(H+)=c(SCN-)+c(OH-),则c(Na+)>c(SCN-),故B错误。
C. R点为HSCN和NaSCN的混合溶液,HSCN的电离程度等于SCN-的水解程度,溶液呈中性,而Q时-1gc水(H+)=7,Q点的溶液为NaSCN和NaOH的混合溶液,溶液呈碱性,因此R、Q两点溶液中对应的氢离子浓度不相等,故C错误;
D. -1gc水(H+)越小,水的电离出的越大。N点是水的电离程度最大的点,此时溶液是NaSCN溶液,酸与碱恰好反应,则b=25.00,故D正确;
答案选D。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50mL0.50molL-1盐酸倒入小烧杯中,测出盐酸的温度,然后把温度计上的酸用水冲洗干净;②用另一量筒量取50mL0.55molL-1NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度.回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是 ______ (填序号)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)假设盐酸和氢氧化钠溶液的密度都是1gcm-3,又知中和反应后生成溶液的比热容c=4.18Jg-1℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热△H= ______ (结果保留一位小数)。
(3) ______(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 ______。