题目内容
【题目】X、Y和W为原子序数依次递增的短周期元素,X和Y同主族,Y和W的气态氢化物具有相同的电子数,W的单质是黄绿色气体,X的单质只有氧化性。
(1)写出实验室制取W2反应的离子方程式_____________。
(2)成外高一化学兴趣小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究YX2和W2的性质。
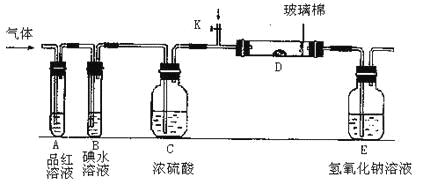
①分别通入YX2和W2,在装置A中观察到的现象是否相同(填“相同”或“不相同”)__________;若装置D中装的是铁粉,当通入W2时观察到的现象为______________;若装置D中装的是催化剂,当通入YX2时,打开K通入适量X2,化学反应方程式为___________________;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量W2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为__________________。
(3)某同学将足量的YX2通入一支装有氯化钡溶液的试管,未见沉淀生成,向该试管中加入过量(填字母)________________,可以看到白色沉淀生成,其原因分别为________________________________________________________________________。
A.氨水 B.稀盐酸 C.稀硝酸 D.氯化钙
(4)若由元素Y和X组成 酸根Z(Y2X32-),当W2与含Z的溶液完全反应后,有浅黄色沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,该反应的离子方程式为_____________________________________________________________________。
【答案】MnO2+4H-+2Cl-![]() Mn2++Cl2↑+2H2O 相同 产生棕黄色的烟 2SO2+O2
Mn2++Cl2↑+2H2O 相同 产生棕黄色的烟 2SO2+O2![]() 2SO3 5Cl2+I2+6H2O=2HIO3+10HCl AC 当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀 S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+
2SO3 5Cl2+I2+6H2O=2HIO3+10HCl AC 当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀 S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+
【解析】
W的单质是黄绿色气体,则W为氯(Cl),X的单质只有氧化性,则X不可能是氟,只能是氧(O),从而得出Y为硫(S),YX2为SO2,W2为Cl2。
(1)实验室用MnO2与浓盐酸反应制取Cl2,反应的离子方程式为MnO2+4H-+2Cl-![]() Mn2++Cl2↑+2H2O。答案为:MnO2+4H-+2Cl-
Mn2++Cl2↑+2H2O。答案为:MnO2+4H-+2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)①分别通入SO2和Cl2,它们都能使品红溶液褪色,所以在装置A中观察到的现象相同;若装置D中装的是铁粉,当通入Cl2时,二者发生反应生成FeCl3,观察到的现象为产生棕黄色的烟;若装置D中装的是催化剂,当通入SO2时,打开K通入适量O2,发生反应生成SO3,化学反应方程式为2SO2+O2![]() 2SO3。答案为:相同;产生棕黄色的烟;2SO2+O2
2SO3。答案为:相同;产生棕黄色的烟;2SO2+O2![]() 2SO3;
2SO3;
②若装置B中装有5.0mL 1.0×10-3mol/L的碘水,当通入足量Cl2完全反应后,转移了5.0×10-5mol电子,则1molI2参加反应失去10mole-,I由0价升高到+5价,即生成HIO3,同时Cl2转化为Cl-,该反应的化学方程式为5Cl2+I2+6H2O=2HIO3+10HCl。答案为:5Cl2+I2+6H2O=2HIO3+10HCl;
(3)某同学将足量的SO2通入一支装有氯化钡溶液的试管,由于反应生成BaSO3和HCl的量很少,所以未见沉淀生成,若要看到有沉淀生成,要么加碱中和HCl,促使平衡正向移动,要么加入强氧化剂,将BaSO3转化为BaSO4,所以向该试管中加入过量A(氨水)、C(稀硝酸),都可以看到白色沉淀生成,其原因分别为:当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀。答案为:A、C;当加入氨水时,使该溶液变为碱性,产生BaSO3白色沉淀;当加入HNO3时,使溶液中H2SO3氧化成H2SO4,产生BaSO4白色沉淀;
(4)若由元素Y和X组成S2O32-,当Cl2与含S2O32-的溶液完全反应后,有浅黄色S沉淀产生,取上层清液加入氯化钡溶液,有白色沉淀产生,则生成BaSO4,表明原溶液中含有SO42-,该反应的离子方程式为S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+。答案为:S2O32-+Cl2+H2O=SO42-+S↓+2Cl-+2H+。

【题目】把温度为20℃,浓度为1.0mol·L-1的H2SO4和2.2mol·L-1的碱溶液各50ml混合(溶液密度均为1g·ml-1,比热容为4.184kJ·K-1·kg-1),轻轻搅动。测得酸碱混合液的温度变化数据如下,则反应NH3·H2O=NH4++OH-的焓变约为(单位:kJ·mol-1)
反应物 | 起始温度T1/℃ | 终止温度T2/℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
A. +2.1 B. +52.7 C. ;+4.2 D. -4.2
【题目】某小组以亚硝酸钠(NaNO2)溶液为研究对象,探究NO2-的性质。
实验 | 试剂 | 编号及现象 | |
滴管 | 试管 | ||
2mL | 1%酚酞溶液 | 1 mol·L-1 NaNO2溶液 | 实验I:溶液变为浅红色,微热后红色加深 |
1 mol·L-1 NaNO2溶液 | 0.1 mol·L-1 KMnO4 溶液 | 实验II:开始无明显变化,向溶液中滴加稀硫酸后紫色褪去 | |
KSCN溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验III:无明显变化 | |
1 mol·L-1 NaNO2溶液 | 1 mol·L-1 FeSO4 溶液(pH=3) | 实验IV:溶液先变黄,后迅速变为棕色,滴加KSCN溶液变红 | |
资料:[Fe(NO)]2+在溶液中呈棕色。
(1)结合化学用语解释实验I“微热后红色加深”的原因 ______
(2)实验II证明NO2-具有_____性, 从原子结构角度分析原因_________
(3)探究实验IV中的棕色溶液
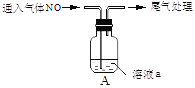
①为确定棕色物质是NO与Fe2+,而非Fe3+发生络合反应的产物,设计如下实验,请补齐实验方案。
实验 | 溶液a | 编号及现象 |
| 1 mol·L-1FeSO4溶液(pH=3) | i.溶液由___色迅速变为___色 |
____________________ | ii.无明显变化 |
②加热实验IV中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释上述现象产生的原因_________。
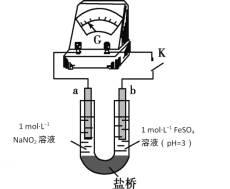
(4)络合反应导致反应物浓度下降,干扰实验IV中氧化还原反应发生及产物检验。小组同学设计实验V:将K闭合后电流表指针发生偏转,向左侧滴加醋酸后偏转幅度增大。
①盐桥的作用是____________________________
②电池总反应式为______________________
实验结论:NO2-在一定条件下体现氧化性或还原性,氧还性强弱与溶液酸碱性等因素有关。