题目内容
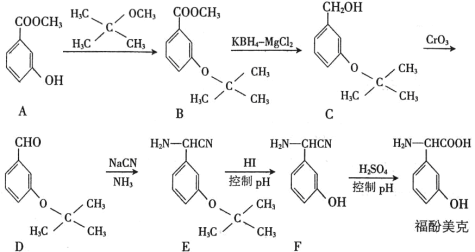
【题目】将一定量氨基甲酸铵加入恒容容器中:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法错误的是
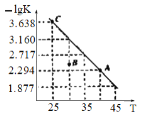
A. 该反应的生成物总能量大于反应物总能量
B. 处于A点的CO2的消耗速率大于处于C点的CO2消耗速率
C. B点时,v逆>v正
D. CO2的体积分数不变时反应一定达到平衡状态
【答案】D
【解析】
A.温度升高平衡常数的负对数(-lgK)减小,即温度越高K值越大,所以正反应是吸热反应,生成物总能量大于反应物总能量,故A项正确;
B.温度越高反应速率越快,A点的温度高于C点,因此A点CO2平均反应速率高于C点,故B项正确;
C.B点未平衡,最终要达平衡状态,平衡常数的负对数要变大,即此时Q>K,所以反应逆向进行,v逆>v正,故C项正确;
D.体系中两种气体的物质的量之比始终不变,所以CO2的体积分数不变时,该反应不一定达到平衡状态,故D项错误;
综上,本题选D。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】某小组探究Br2、I2能否将Fe2+氧化,实验如下。
实验 | 试剂x | 现象及操作 |
| 溴水 | i.溶液呈黄色,取出少量滴加KSCN溶液,变红 |
碘水 | ii.溶液呈黄色,取出少量滴加KSCN溶液,未变红 |
(1)实验ⅰ中产生Fe3+ 的离子方程式是________。
(2)以上实验体现出氧化性关系:Br2_______I2(填“>”或“<”)。
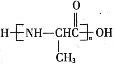
(3)针对实验ⅱ中未检测到Fe3+,小组同学I2 +2Fe2+ ![]() 2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
2Fe3+ + 2I-(反应a),限度小,产生的c(Fe3+)低;若向ⅱ的黄色溶液中加入AgNO3溶液,可产生黄色沉淀,平衡向_____移动,c(Fe3+)增大。
(4)针对小组同学的分析,进行实验ⅲ:向ⅱ的黄色溶液中滴加足量AgNO3溶液。现象及操作如下:
Ⅰ.立即产生黄色沉淀,一段时间后,又有黑色固体从溶液中析出;取出少量黑色固体,洗涤后,_________(填操作和现象),证明黑色固体含有Ag。
Ⅱ.静置,取上层溶液,用KSCN溶液检验,变红;用CCl4萃取,无明显现象。
(5)针对上述现象,小组同学提出不同观点并对之进行研究。
① 观点1:由产生黄色沉淀不能判断反应a的平衡正向移动,说明理由:______。经证实观点1合理。
② 观点2:Fe3+ 可能由Ag+ 氧化产生。
实验ⅳ:向FeSO4溶液滴加AgNO3溶液,_____(填现象、操作),观点2合理。
(6)观点1、2虽然合理,但加入AgNO3溶液能否使反应a的平衡移动,还需要进一步确认。设计实验:取ⅱ的黄色溶液,______(填操作、现象)。由此得出结论:不能充分说明(4)中产生Fe3+的原因是由反应a的平衡移动造成的。