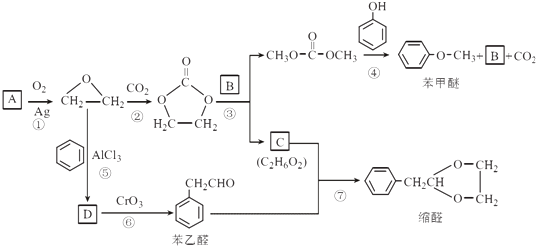
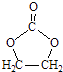
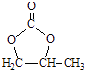
题目内容
【题目】锗是重要的半导体材料,应用于航空航天测控、光纤通讯等领域.一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下: 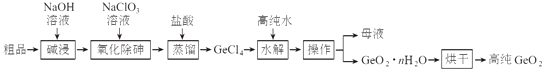
已知:①“碱浸”过程中的反应为:
GeO2+2NaOH═Na2GeO3+H2O
As2O3+2NaOH═2NaAsO2+H2O
②“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O
③GeCl4的熔点为﹣49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃.
(1)锗的原子序数为32,锗在元素周期表中的位置为第周期族.
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4 , 其反应方程式为: .
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是 .
(4)工业上与蒸馏操作相关的设备有
A.蒸馏釜
B.离心萃取机
C.冷凝塔
D.加压过滤机
(5)“水解”操作时发生的化学反应方程式为 , “水解”操作时保持较低温度有利于提高产率,其最可能的原因是(答一条即可).
(6)若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的高纯二氧化锗产品,则杂质脱除率为 .
【答案】
(1)四;IVA
(2)3NaAsO2+NaClO3+6NaOH=3Na3AsO4+NaCl+3H2O
(3)馏出物中将会含有AsCl3 , 降低了产品纯度
(4)AC
(5)GeCl4+(n+2)H2O=GeO2?nH2O↓+4HCl;该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率
(6)85%
【解析】解:二氧化锗粗品(主要含GeO2、As2O3)中加入NaOH溶液碱浸,发生的反应为GeO2+2NaOH═Na2GeO3+H2O、As2O3+2NaOH═2NaAsO2+H2O,向溶液中加入NaClO3氧化除砷,发生的反应为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,向溶液中加入稀盐酸并蒸馏,“蒸馏”过程中的反应为:Na2GeO3+6HCl═2NaCl+GeCl4+3H2O,所以得到GeCl4 , 向GeCl4中加入高纯水,发生的水解反应为GeCl4+(n+2)H2O=GeO2n H2O↓+4HCl,然后过滤得到母液和GeO2n H2O,将GeO2n H2O烘干得到高纯的GeO2 , (1)锗的原子序数为32,锗在元素周期表中的位置为第四周期IVA族,所以答案是:四;IVA;(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4 , 同时氯酸钠被还原生成氯化钠,根据反应物和生成物书写反应方程式为3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O,所以答案是:3NaAsO2+NaClO3+6 NaOH=3 Na3AsO4+NaCl+3H2O;(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是馏出物中将会含有AsCl3 , 降低了产品纯度,所以答案是:馏出物中将会含有AsCl3 , 降低了产品纯度;(4)工业上与蒸馏操作相关的设备有蒸馏釜和冷凝塔,故选AC;(5)“水解”时生成GeO2n H2O和HCl,反应方程式为GeCl4+(n+2)H2O=GeO2n H2O↓+4HCl,该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率,所以采用低温水解,所以答案是:GeCl4+(n+2)H2O=GeO2n H2O↓+4HCl;该水解反应为放热反应,温度较低时反应平衡常数较大,反应物平衡转化率更高;或温度高时GeCl4易挥发降低产率;(6)1吨二氧化锗粗品(含杂质30%)中杂质质量=1t×30%=0.3t,纯的二氧化锗质量=1t×(1﹣30%)=0.7t,实际上经提纯得0.745吨的高纯二氧化锗产品,则提纯得到的二氧化锗中杂质质量=(0.745﹣0.7)t=0.045t,杂质去除率= ![]() ×100%=85%, 所以答案是:85%.
×100%=85%, 所以答案是:85%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去): 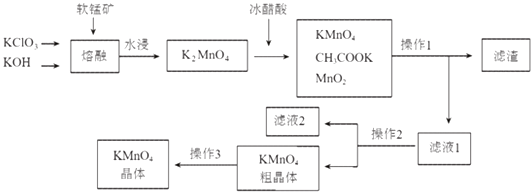
相关物质不同温度下的溶解度(单位:g)数据如表:
物质 | KMnO4 | CH3COOK | K2SO4 | KCl |
20℃ | 6.34 | 217 | 11.1 | 34.2 |
90℃ | 45.2 | 398 | 22.9 | 53.9 |
(1)“熔融”步骤反应的化学方程式为 .
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为: .
(3)操作2是、、 .
(4)图中可以直接进行循环利用的物质是(填化学式) .
(5)KMnO4粗晶体中的主要杂质(填化学式)有和 , 若用硫酸代替图中的冰醋酸,则导致的问题及原因是 .