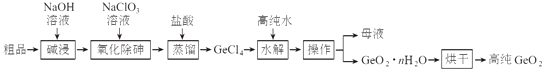
题目内容
【题目】1g碳与适量水蒸气反应生成CO和H2 , 需吸收10.94KJ热量,此反应的热化学方程式为 .
【答案】C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJ?mol﹣1
【解析】解:由1g碳与适量水蒸气反应生成CO和H2 , 需吸收10.94kJ热量,则1mol碳与水蒸气反应,吸收10.94KJ×12=131.28kJ,则此反应的热化学方程式为C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJmol﹣1 ,
所以答案是:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.28kJmol﹣1 .

练习册系列答案
相关题目