题目内容
【题目】高锰酸钾是一种常用的氧化剂.下图是利用软锰矿(主要成分为MnO2)制备高锰酸钾的一种工艺(流程中部分产物已略去): 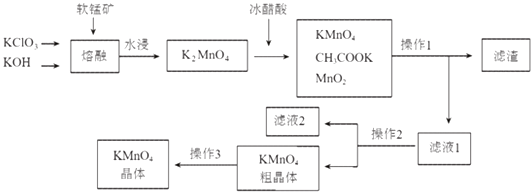
相关物质不同温度下的溶解度(单位:g)数据如表:
物质 | KMnO4 | CH3COOK | K2SO4 | KCl |
20℃ | 6.34 | 217 | 11.1 | 34.2 |
90℃ | 45.2 | 398 | 22.9 | 53.9 |
(1)“熔融”步骤反应的化学方程式为 .
(2)K2MnO4溶液中加入冰醋酸发生反应的离子方程式为: .
(3)操作2是、、 .
(4)图中可以直接进行循环利用的物质是(填化学式) .
(5)KMnO4粗晶体中的主要杂质(填化学式)有和 , 若用硫酸代替图中的冰醋酸,则导致的问题及原因是 .
【答案】
(1)3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
(2)3MnO42﹣+4CH3COOH=2MnO4﹣+MnO2↓+2H2O+4CH3COO﹣
(3)蒸发浓缩;冷却结晶;过滤
(4)MnO2
(5)KCl;CH3COOK;反应生成K2SO4 , 而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低
【解析】解:软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,锰酸钾中加入冰醋酸自身发生氧化还原反应生成二氧化锰、高锰酸钾和醋酸钾,操作Ⅰ是溶解过滤得到滤渣为二氧化锰,操作Ⅱ是滤液2通过加热浓缩、降温结晶、过滤洗涤得到高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,通过重结晶的方法提纯高锰酸钾晶体,(1)软锰矿中的二氧化锰和加入氯酸钾和氢氧化钾熔融发生氧化还原反应生成锰酸钾、氯化钾和水,结合原子守恒和电子守恒配平书写化学方程式,锰元素化合价+4价变化为+6价电子转移2e﹣ , 氯酸钾中氯元素+5价变化为﹣1价,电子转移6e﹣ , 电子转移总数6e﹣ , 则反应的化学方程式为:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O,所以答案是:3MnO2+KClO3+6KOH
3K2MnO4+KCl+3H2O,所以答案是:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O;(2)K2MnO4溶液中加入冰醋酸发生反应是自身氧化还原反应生成高锰酸钾和二氧化锰,结合电子守恒、电荷守恒和原子守恒书写离子方程式,锰元素+6价变化为+7价和+4价,电子转移总数2e﹣,配平得到离子方程式为:3MnO42﹣+4CH3COOH=2MnO4﹣+MnO2↓+2H2O+4CH3COO﹣ ,
3K2MnO4+KCl+3H2O;(2)K2MnO4溶液中加入冰醋酸发生反应是自身氧化还原反应生成高锰酸钾和二氧化锰,结合电子守恒、电荷守恒和原子守恒书写离子方程式,锰元素+6价变化为+7价和+4价,电子转移总数2e﹣,配平得到离子方程式为:3MnO42﹣+4CH3COOH=2MnO4﹣+MnO2↓+2H2O+4CH3COO﹣ ,
所以答案是:3MnO42﹣+4CH3COOH=2MnO4﹣+MnO2↓+2H2O+4CH3COO﹣;(3)操作Ⅱ是溶液中得到溶质固体,依据表中溶解度分析可知,溶解度随温度变化较大,可以用冷却热饱和溶液的方法得到,操作2为滤液2通过蒸发浓缩、冷却结晶、过滤洗涤得到高锰酸钾粗晶体,
所以答案是:蒸发浓缩、冷却结晶、过滤;(4)参加反应过程最后又生成的物质可以循环使用,上述分析可知二氧化锰参与反应又生成可以循环使用,
所以答案是:MnO2;(5)高锰酸钾粗晶体,所含杂质主要为KCl、CH3COOK等,若用硫酸代替图中的冰醋酸,生成的硫酸钾溶解度小易在晶体中含有更多杂质,硫酸酸性太强,导致MnO4﹣将Cl﹣氧化,产生有毒的Cl2 , KMnO4损失且纯度降低,
所以答案是:KCl,CH3COOK,反应生成K2SO4 , 而K2SO4在常温下的溶解度也较小,析出后从而导致产品的纯度降低或硫酸酸性太强,导致MnO4﹣将Cl﹣氧化,产生有毒的Cl2 , KMnO4损失且纯度降低;

 新思维寒假作业系列答案
新思维寒假作业系列答案