��Ŀ����
����Ŀ����Ԫ�صĻ������ж��֡�
�ش��������⣺
��1��SiH4�ķе��CH4�ߣ�ԭ����____________________________________��
��2������̼ͬ���壬Ҳ��ϵ���⻯�������������������϶�Զ���������ࡣ�����±��� ���м������ݣ���Ҫ�������ܵ�ԭ��___________________________________��
��ѧ�� | C��C | C��H | Si��Si | Si��H |
����/(kJ��mol-1) | 356 | 413 | 226 | 318 |
�����裨Si3N4����һ����Ҫ���մɲ��ϣ�����ʯӢ�뽹̿��800��ĵ��������ºϳɣ�
3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
��3�����������Ӧ�е���ת�Ƶ���Ŀ�ͷ���____________��
��4���÷�Ӧ��ƽ�ⳣ������ʽK=____________����֪ƽ�ⳣ����K(800��)>K(850��)����Ӧ��_________��Ӧ������ȡ������ȡ�����
��5����д��������߶�������ת���ʵĴ�ʩ_________________��_________________��
��6��һ���¶��£���2L�ܱ������ڣ�����һ�����ķ�Ӧ�5����ʱ�ﵽƽ�⣬�������������������0.4mol����CO��ʾ�÷�Ӧʱ���ڵķ�Ӧ����Ϊ_________________��
���𰸡� �����ǽṹ���Ƶķ��Ӿ��壬SiH4�ķ�������CH4�ķ��������»��������Էе��CH4�ߡ� Si��Si�ļ��ܱ�C��CС��Si��H�ļ���Ҳ��C��HС���������ѣ����Թ����������������������١� 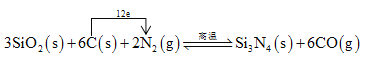
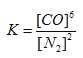 ���� ���� ��Сѹǿ 0.06mol/(L��min)
���� ���� ��Сѹǿ 0.06mol/(L��min)
�����������������(1)���Ӿ���ķе�����Է�����������������ߣ�(2)����Խ������Խ�ȶ���(3) 3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ�(4)���ݻ�ѧ����ʽ��дƽ�ⳣ���������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ���(5)ƽ�������ƶ���ʹ��������ת��������(6)���ò�������������CO�����ʵ�����������
Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ�(4)���ݻ�ѧ����ʽ��дƽ�ⳣ���������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ���(5)ƽ�������ƶ���ʹ��������ת��������(6)���ò�������������CO�����ʵ�����������![]() �������ʡ�
�������ʡ�
������(1)���Ӿ���ķе�����Է�����������������ߣ������ǽṹ���Ƶķ��Ӿ��壬SiH4�ķ�������CH4�ķ��������»��������Էе��CH4�ߣ�(2)����Խ������Խ�ȶ���Si��Si�ļ��ܱ�C��CС��Si��H�ļ���Ҳ��C��HС���������ѣ����Թ����������������������٣�(3) 3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ����Ե���ת�Ƶķ���� ��ĿΪ
Si3N4(s)+6CO(g) ��Ӧ�е�Ԫ�صõ��ӻ��ϼ۽���̼Ԫ��ʧ���ӻ��ϼ����ߣ����Ե���ת�Ƶķ���� ��ĿΪ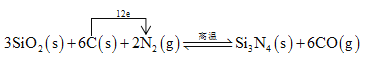 ��(4)���岻��д��ƽ�ⳣ������ʽ�����ݻ�ѧ����ʽ��ƽ�ⳣ��
��(4)���岻��д��ƽ�ⳣ������ʽ�����ݻ�ѧ����ʽ��ƽ�ⳣ��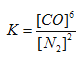 �������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ������Ը÷�Ӧ���ȣ�(5) ���� ���Сѹǿ��ʹƽ�������ƶ�����������ת��������(6)��5����CO���ʵ�������xmol
�������¶�ƽ�ⳣ����С��˵��ƽ�������ƶ������Ը÷�Ӧ���ȣ�(5) ���� ���Сѹǿ��ʹƽ�������ƶ�����������ת��������(6)��5����CO���ʵ�������xmol
3SiO2(s)+6C(s)+2N2(g) ![]() Si3N4(s)+6CO(g) �������ʵ�������
Si3N4(s)+6CO(g) �������ʵ�������
6 6-2
x 0.4
![]() �� x=0.6��
�� x=0.6�� ![]() =
=![]() 0.06mol/(L��min)��
0.06mol/(L��min)��

 ��������ϵ�д�
��������ϵ�д�