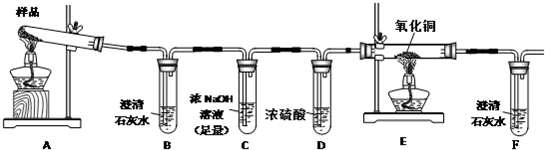
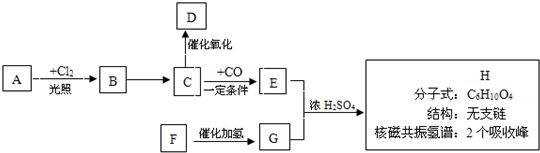
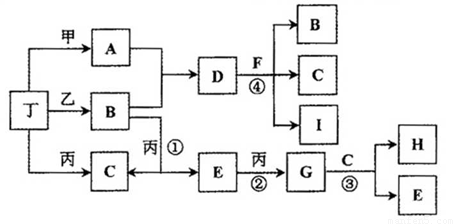
��Ŀ����
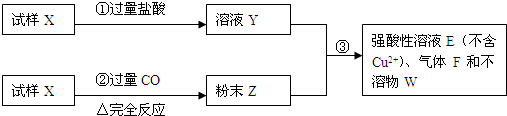
����Fe��FeO��Fe2O3��ɵĻ�����м���100 mL 2 mol��L-1�����ᣬǡ��ʹ�������ȫ�ܽ⣬���ų�448 mL���壨��״��������ʱ��Һ����Fe3+���ڡ��������ж���ȷ����
- A.��������������ʷ�Ӧ�����ĵ���������ʵ���֮��Ϊ1��1��3
- B.������Fe2O3�����ʵ�����ȷ������Fe��FeO�����ʵ�����
- C.������FeO�����ʵ�����ȷ������Fe��Fe2O3�����ʵ�����
- D.��Ӧ��������Һ�е�Fe2+��Cl-�����ʵ���֮��Ϊ1��3
C
�����⣬���ڷ�Ӧ��������ų�����Һ�в�����Fe3+����n(Fe)��n(Fe2O3)����FeO�����ʵ����ء����ղ���ΪFeCl2����n(Fe2+)= n(Cl-)��
n(Cl-)��
�����⣬���ڷ�Ӧ��������ų�����Һ�в�����Fe3+����n(Fe)��n(Fe2O3)����FeO�����ʵ����ء����ղ���ΪFeCl2����n(Fe2+)=
 n(Cl-)��
n(Cl-)�� 
��ϰ��ϵ�д�
 ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
ȫ�ŵ�����Ԫ�ƻ�ϵ�д�
�����Ŀ
 ��+����δ��ƽ������ƽ����ټ�����B����ƽ�� �ƶ�������� ����������������ƽ�����ԭƽ����ȣ�B��ת����
������� ����С�����䡱����
��+����δ��ƽ������ƽ����ټ�����B����ƽ�� �ƶ�������� ����������������ƽ�����ԭƽ����ȣ�B��ת����
������� ����С�����䡱����