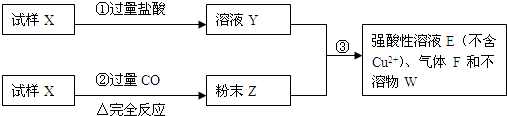
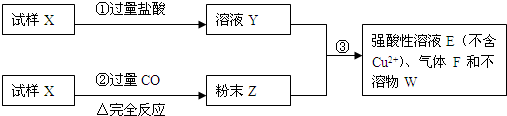
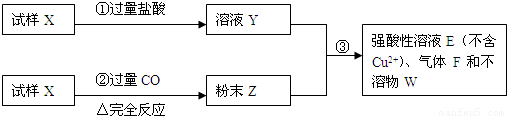
题目内容

(1)请写出步骤①中发生的全部反应的离子方程式
(2)请写出步骤③中发生的全部反应的离子方程式
(3)若全部的溶液Y和全部的粉末Z充分反应生成不溶物W的质量为32g,气体F在标准状况下体积为5.6L,所得溶液的体积为200mL,则每份试样X的质量
(2)先判断粉末Z的成分,再根据溶液E不含铜离子判断该溶液成分,根据有气体生成,判断反应过量的物质,从而确定W的成分,写出相应的离子方程式;
(3)根据铜的质量计算氧化铜的质量,氧化铜质量的一半为试样X中氧化铜的质量;根据铜的质量的一半计算铁的质量,根据气体的体积计算与酸反应的铁的质量,然后用两部分铁的质量计算试样中氧化亚铁的质量;氧化铜和氧化亚铁的质量和为试样中固体的质量.
两份试样中氧化亚铁全部转化为二价铁离子,所以根据氧化亚铁的质量计算二价铁离子的物质的量,再根据浓度公式计算其浓度.
所以溶液Y为氯化亚铁和氯化铜的混合溶液.
故答案为:FeO+2H+=Fe2++H2O;CuO+2H+=Cu2++H2O.
(2)因为CuO+CO
| ||
| ||
强酸性溶液E不含铜离子,且有气体F生成,所以铁与铜离子反应铁过量,铁还和酸反应,所以铁和酸反应的离子方程式为:Fe+2H+=Fe2++H2↑;
故答案为:Fe+Cu2+=Cu+Fe2+;Fe+2H+=Fe2++H2↑.
(3)溶物W为铜,铜有两部分来源,一部分是CO还原出的铜,一部分为铁与铜离子反应置换出的铜,所以以W的一半计算试样中的氧化铜的质量;
CuO--Cu
80g 64g
20g 16g
所以试样中氧化铜的质量为20g;
粉末Z中的铁单质,一部分和铜离子发生置换反应,一部分和酸发生置换反应,根据粉末Z中的铁单质计算试样中的氧化亚铁的质量.
Fe+Cu2+=Cu+Fe2+;
56g 64g
14g 16g
所以和铜离子发生置换反应的铁为14g;
Fe+2H+=Fe2++H2↑
56 22.4L
14g 5.6L
所以与酸反应的铁的质量是14g;
即粉末Z中铁的质量为14g+14g=28g;
FeO--Fe
72g 56g
36g 28g
所以试样中含FeO 36g;
所以试样的质量为20g+36g=56g
最终两份试样中的氧化亚铁全部转化为Fe2+,两份试样中氧化亚铁的质量为36g×2=72g.
FeO--Fe2+
72g 1mol
72g 1mol
所以Fe2+的物质的量为1mol,C(Fe2+)=
| n |
| V |
| 1mol |
| 0.2L |
故答案为:56g;5mol/L.

将MgCl2溶液加入NaOH和Na2CO3的混合溶液中,溶液中的离子反应如下:先发生Mg2++2OH-===Mg(OH)2↓,后发生Mg2++CO![]() ===MgCO3↓;经查溶解度表得知, Mg(OH)2的溶解度小于MgCO3的溶解度。在溶解度表中有这样一组数据,表示四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂),如下表:
===MgCO3↓;经查溶解度表得知, Mg(OH)2的溶解度小于MgCO3的溶解度。在溶解度表中有这样一组数据,表示四种物质在水中、液氨中的溶解度(g溶质/100 g溶剂),如下表:
| 溶质 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水 | 170 | 9.3 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
(1)分别是1.0 mol· L-1的Ag+、Ba2+、NO![]() 和Cl-在水中发生反应的离子方程式是______________________________________________________________。
和Cl-在水中发生反应的离子方程式是______________________________________________________________。
(2)分别是0.50 mol· L-1的以上四种离子在液氨中发生反应的离子方程式是__________________________________________________。
II(6分)、某100mL溶液中含有的部分离子浓度大小如图所示,该溶液可能还含有
 Fe3+、Ba2+、K+、OH-、NO3-、
Fe3+、Ba2+、K+、OH-、NO3-、![]() 、
、![]() 。为了进一步确认,对该溶液进行实验检测:
。为了进一步确认,对该溶液进行实验检测:
①仔细观察,该溶液呈无色、透明、均一状态。
②向100mL溶液中滴入稀硫酸,有23.3g白色沉淀产生,再加稀硝酸,白色沉淀不消失。回答下列问题:由此可知,除了含有Na+、Mg2+、Cl-外,该溶液中肯定还含有的离子及其物质的量浓度为___________,肯定没有的离子是___________,可能含有的离子是___________。
III(6分).试样X由氧化亚铁和氧化铜组成。取质量相等的两份试样进行下图所示实验:

(1)写出步骤③发生的全部反应的离子方程式。
(2)若Y和Z充分反应,生成的不溶物的质量是m,则每份试样X中氧化铜的质量为 (用m表示)。