题目内容
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为( )
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
A
解析试题分析:n(Cu)=" 51.2" g÷64g/mol=0.8mol.Cu失去电子的物质的量是0.8×2="1.6mol." 硝酸得到电子产生氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,,n(NaOH)=1mol.由于氮的氧化物都转化为NaNO3或NaNO2.n(N)n(Na)=1:1,所以n(N2O4)=0.2mol;n(NO+NO2)=0.6mol..假设收集到氮的氧化物(含NO、N2O4、NO2)的混合物0.8 mol,含有二氧化氮的物质的量为a ,一氧化氮的物质的量为(0.6-a)mol, n(N2O4)=0.2mol.根据电子守恒可得:1×a+3×(0.6-a)+2×0.2=1.6.解得a=0.3mol.因为N2O4 2NO2.
2NO2.
收集到氮氧化物也就相当于是n(NO2)=0.3+2×0.2=0.7mol.,n(NO)=0.3mol.。结合两个方程式可知发生第二个反应的二氧化氮、一氧化氮的物质的量都是0.3mol,发生第一个反应的二氧化氮物质的量为0.4mol.所以产生NaNO30.2mol, 产生NaNO20.2mol+0.3mol="0.8mol."
考点:考查Cu与适量浓硝酸反应产物的知识。

下列溶液中的Cl-的物质的量与50 mL 1 mol ·L-1 MgCl2溶液中相等的是
| A.150 mL 1 mol·L-1的NaCl溶液 | B.75 mL 0.5mol·L-1的CaCl2溶液 |
| C.50 mL 2 mol·L-1的KCl溶液 | D.75 mL 1 mol ·L-1的FeCl3溶液 |
下列关于叙述正确的是
| A.物质的量是含有一定数目粒子的集合体 |
| B.摩尔质量就是该物质的相对分子质量或相对原子质量 |
| C.单位物质的量的物质所占的体积就是气体摩尔体积 |
| D.40gNaOH溶解在1L水中,形成溶液溶质的物质的量浓度为1 mol/L |
某同学按下图所示的步骤配制50mL 一定物质的量浓度的NaOH溶液,其中不正确的操作有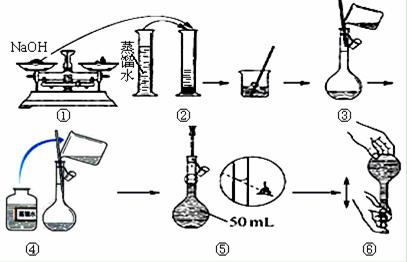

| A.②⑤ | B.①②⑤ | C.①②③⑤ | D.①②③④⑤ |
下列关于阿佛加德罗常数(NA)说法正确的是( )
| A.常温常压下,当活泼金属转移2NA个电子时,可从盐酸中置换产生22.4LH2 |
| B.1mol氯气与足量的氢氧化钠反应,共转移了NA的电子 |
| C.标准状况下, 2.24L甲烷和氨气的混合气中所含的电子数为NA |
| D.1mol/L的Na2S溶液中,含有的S2-的数目小于NA |
一定量CO2通入2L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述不正确的是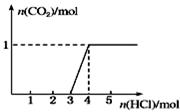
| A.通入的CO2气体在标准状况下的体积约为22.4 L |
| B.原溶液中c(NaOH)=2mol/L |
| C.A溶液中含Na2CO3和NaHCO3各1mol |
| D.A溶液中含有2molNaOH和1mol Na2CO3 |
标准状况下,在三个干燥烧瓶一瓶为干燥纯净氨气,一瓶含一半空气的氯化氢和一瓶为二氧化氮和氧气的混合气(体积比:V(NO2):V(O2)=4:1),然后分别做喷泉实验,则三瓶中所得溶液的物质的量浓度之比为( )
| A.2:1:2 | B.5:5:4 | C.1:1:1 | D.无法确定 |
标准状况下有①6.72L甲烷,②3.01×1023个氯化氢分子,③13.6gH2S气体,④0.2mol氨气。下列对这四种气体的关系从小到大表示不正确的是( )
| A.氢原子数②<④<③<① | B.密度①<④<③<② |
| C.质量④<①<③<② | D.体积④<①<②<③ |
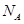 表示阿伏加德罗常数,下列说法正确的是 ( )
表示阿伏加德罗常数,下列说法正确的是 ( )