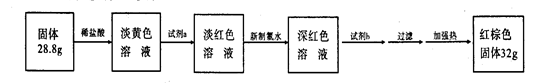
题目内容
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如下:
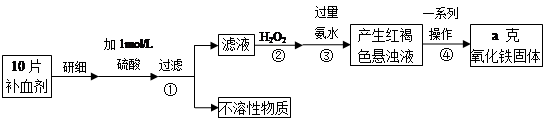
请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被 (填“氧化”或“还原”)为 Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含 和 (填化学式).
(3)步骤④中一系列处理的操作步骤为 、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是 .
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为 .
(6)下列操作会导致所测定的铁元素含量偏高的是
A. 步骤③所加氨水量不足 B. 步骤④洗涤不充分 C. 步骤④灼烧不充分

请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被 (填“氧化”或“还原”)为 Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含 和 (填化学式).
(3)步骤④中一系列处理的操作步骤为 、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是 .
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为 .
(6)下列操作会导致所测定的铁元素含量偏高的是
A. 步骤③所加氨水量不足 B. 步骤④洗涤不充分 C. 步骤④灼烧不充分
(1)氧化 (2)(NH4)2SO4、Fe(OH)3 (3)过滤
(4)100 mL容量瓶、胶头滴管 (5)7a/b % (6)BC
(4)100 mL容量瓶、胶头滴管 (5)7a/b % (6)BC
试题分析:(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,故答案为:氧化; (2)根据反应图示,过量的硫酸能够与氨水反应生成硫酸铵;红褐色的物质是氢氧化铁,故答案为:(NH4)2SO4;Fe(OH)3; (3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:过滤;(4)精确配制100mL 1mol/L的硫酸溶液,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、100mL容量瓶,所以还需要100mL容量瓶、胶头滴管,故答案为:100mL容量瓶、胶头滴管; (5)10片补血剂中氧化铁的物质的量为:a/160mol,含有的铁元素质量为:2×a/160×56g=0.7ag,每片补血剂含铁元素的质量分数为:(1/10)×0.7a/b×100%=7a/b%.故答案为:7a/b%
(6)A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,故A错误;B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,故B正确;C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,故C正确;故选BC.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目