题目内容
【题目】A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,C元素原子的最外层电子数是其内层电子数的3倍,D元素的主族序数等于其周期数,E元素原子的最外层电子数是其电子层数的2倍,G单质是日常生活中用量最大的金属,易被腐蚀,试回答下列问题:
![]() 元素的同位素有 ______
元素的同位素有 ______ ![]() 写原子符号
写原子符号![]()
![]() 实验室中制取B的简单氢化物的化学反应方程式 ______
实验室中制取B的简单氢化物的化学反应方程式 ______
![]() 、D、E的简单离子半径由大到小的顺序是 ______
、D、E的简单离子半径由大到小的顺序是 ______ ![]() 用离子符号表示
用离子符号表示![]() ,请用化学事实说明C与E这两种元素非金属性的强弱 ______
,请用化学事实说明C与E这两种元素非金属性的强弱 ______ ![]() 举一例
举一例![]()
![]() 向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F元素的离子,其中两种离子的物质的量
向NaOH溶液中通入一定量的F单质,两者恰好完全反应,生成物中有三种含F元素的离子,其中两种离子的物质的量![]() 与反应时间
与反应时间![]() 的曲线如图所示,请写出
的曲线如图所示,请写出![]() 时反应的化学方程式 ______
时反应的化学方程式 ______

【答案】![]() H、
H、![]() H、
H、![]()
![]()
![]()
![]() 比
比![]() 稳定
稳定 ![]()
【解析】
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;C元素原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,只能处于第三周期,故D为Al;E元素原子的最外层电子数是其电子层数的2倍,原子序数大于Al,处于第三周期,最外层电子数为6,故E为S元素;G单质是日常生活中用量最大的金属,易被腐蚀,则G为Fe,据此分析解答。
A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐,则B为N元素;C元素原子的最外层电子数是其内层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D元素的主族序数等于其周期数,原子序数大于氧,只能处于第三周期,故D为Al;E元素原子的最外层电子数是其电子层数的2倍,原子序数大于Al,处于第三周期,最外层电子数为6,故E为S元素;G单质是日常生活中用量最大的金属,易被腐蚀,则G为Fe,
![]() 为H元素,其同位素有:
为H元素,其同位素有:![]() H、
H、![]() H、
H、![]() ;
;
故答案为:![]() H、
H、![]() H、
H、![]() ;
;
![]() 的简单氢化物为
的简单氢化物为![]() ,实验室制取氨气的化学反应方程式:
,实验室制取氨气的化学反应方程式:![]() ;
;
故答案为:![]() ;
;
![]() 电子层结构相同,核电荷数越大离子半径越小,电子层数越多离子半径越大,故离子半径:
电子层结构相同,核电荷数越大离子半径越小,电子层数越多离子半径越大,故离子半径:![]() ;水比硫化氢稳定可以说明氧元素的非金属性比硫元素的强;
;水比硫化氢稳定可以说明氧元素的非金属性比硫元素的强;
故答案为:![]() ;
;![]() 比
比![]() 稳定;
稳定;
![]() E为S元素,F为短周期元素,且原子序数比S大,则F为Cl元素,根据图象知,
E为S元素,F为短周期元素,且原子序数比S大,则F为Cl元素,根据图象知,![]() 时次氯酸根离子的物质的量为
时次氯酸根离子的物质的量为![]() ,氯酸根离子的物质的量为
,氯酸根离子的物质的量为![]() ,根据电子转移守恒可知生成氯离子为
,根据电子转移守恒可知生成氯离子为![]() ,所以次氯酸根离子、氯酸根离子、氯离子的物质的量之比为2:1:7,
,所以次氯酸根离子、氯酸根离子、氯离子的物质的量之比为2:1:7,![]() 时氯气和氢氧化钠的反应方程式为:
时氯气和氢氧化钠的反应方程式为:![]() ;
;
故答案为:![]() 。
。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案【题目】X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:![]() 元素原子价电子排布式为
元素原子价电子排布式为![]() ,且原子半径是同族元素中最小的。
,且原子半径是同族元素中最小的。![]() 元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。
元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有一个未成对电子。![]() 元素的电离能数据如表
元素的电离能数据如表![]() :
:
|
|
|
|
|
496 | 4562 | 6912 | 9540 |
|
请回答:
![]() 的电子式为______,含有的化学键类型为______,
的电子式为______,含有的化学键类型为______,![]() 为______晶体。
为______晶体。
![]() 遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
遇水发生强烈水解产生一种气体A,溶液呈碱性,则A的结构式为______,其分子空间构型为______。
![]() 、Y、Z、W四种元素所形成的单质中,硬度最大的是______
、Y、Z、W四种元素所形成的单质中,硬度最大的是______![]() 填物质的名称
填物质的名称![]() ;晶体
;晶体![]() 明显高的原因是______;
明显高的原因是______;![]() 中X原子的杂化轨道类型为______。
中X原子的杂化轨道类型为______。
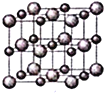
![]() 晶体的结构示意图如图所示。设该晶体的摩尔质量为
晶体的结构示意图如图所示。设该晶体的摩尔质量为![]() ,晶体的密度为
,晶体的密度为![]() 阿伏加德罗常数为
阿伏加德罗常数为![]() ,则晶体中两个最近的Z离子中心间的距离
,则晶体中两个最近的Z离子中心间的距离![]() ______。
______。