题目内容
15.两个密闭容器:甲(定TV),乙(定TP),在甲、乙中各通入2molSO2和1mol O2,在相同的温度下达到如下平衡:2SO2(g)+O2(g)?2SO3(g),对此反应,下述说法不正确的是( )| A. | 反应速率:乙>甲 | B. | SO2的转化率:乙>甲 | ||
| C. | 平衡时各组分含量:乙=甲 | D. | 平衡时容器的压强:乙>甲 |
分析 2SO2(g)+O2(g)?2SO3(g)正反应是气体体积减小的反应,而甲容器保持体积不变,乙容器保持压强不变,但体积减小,乙相当在甲的基础上加压,所以过程中乙容器中压强大于甲容器,反应速率大于甲,平衡转化率乙大于甲,据此分析.
解答 解:A、2SO2(g)+O2(g)?2SO3(g)正反应是气体体积减小的反应,甲容器保持体积不变,乙容器保持压强不变,过程中乙容器中压强大于甲容器,反应速率大于甲,故A正确;
B、过程中乙容器中压强大于甲容器,又该反应为气体体积减小的反应,所以平衡转化率乙大于甲,故B正确;
C、过程中乙容器中压强大于甲容器,又该反应为气体体积减小的反应,所以乙相对于甲还要向正向移动,则平衡时各组分含量:乙≠甲,故C错误;
D、甲容器保持体积不变,乙容器保持压强不变,但体积减小,乙相当在甲的基础上加压,所以乙容器中压强大于甲容器,故D正确;
故选C.
点评 本题考查了化学平衡的影响因素分析判断,恒温恒容、恒温恒压容器的变化特征,题目难度中等,掌握分析方法是关键.

练习册系列答案
相关题目
6.在某体系内有反应物和生成物5种物质:H2S、S、FeCl3、FeCl2、HCl.已知FeCl3为反应物,则另一反应物是( )
| A. | FeCl2 | B. | H2S | C. | S | D. | HCl |
3.下列变化过程中,需要加入氧化剂的是( )
| A. | HCl→H2 | B. | HCl→FeCl2 | C. | Fe→Fe2O3 | D. | H2SO4(浓)→SO2 |
7.下列化学实验操作或事故处理方法不正确的是( )
| A. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸 | |
| B. | 实验台上的酒精灯碰翻着火,立即用湿抹布扑灭 | |
| C. | 皮肤溅上浓H2SO4,应先用干布擦拭并立即用大量水冲洗 | |
| D. | 用激光笔的光束分别照射Fe(OH)3胶体与Na2SO4溶液时的现象相同 |
4.下列各组离子一定能大量共存的是( )
| A. | 在含大量Fe3+的溶液中:NH${\;}_{4}^{+}$、Na+、Cl-、SCN- | |
| B. | 在含有Al3+、Cl-的溶液中:HCO${\;}_{3}^{-}$、I-、NH${\;}_{4}^{+}$、Mg2+ | |
| C. | 在溶质为KNO3和NaHSO4的溶液中:Fe2+、Ca2+、Al3+、Cl- | |
| D. | 常温下,在c(H+)=1×10-13mol•L-1的溶液中:Na+、S2-、SO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ |
5.下列化学药品与其危险化学品图形标志不一致的一组是( )

| A. | 氯酸钾-1 | B. | 天燃气-2 | C. | 铀-3 | D. | 烧碱-4 |
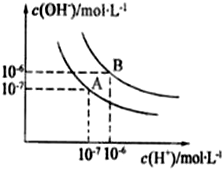 水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.
水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.