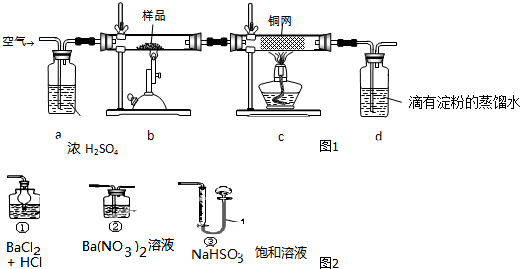
题目内容
10.(用比值填写)同温同压同体积的氨气(NH3)与水蒸气(H2O)的分子数之比为1:1,质量之比为17:18,其中含有的氢原子个数之比为3:2;若 二者氢原子个数相等,则它们的体积之比为2:3.分析 同温同压下相同体积的不同气体其物质的量相等,根据N=nNA、m=nM及分子构成计算二者分子数、质量、H原子个数之比;若二者氢原子个数相等,则二者的物质的量之比为2:3,根据V=nVm计算二者体积之比.
解答 解:同温同压下相同体积的不同气体其物质的量相等,根据N=nNA知,气体分子数与物质的量成正比,二者物质的量相等,所以二者分子数相等,其分子数之比为1:1;
根据m=nM知,相同物质的量时其质量之比等于摩尔质量之比=17g/mol:18g/mol=17:18;
二者分子数相等,根据分子构成知,二者H原子个数之比=3:2;
若二者氢原子个数相等,则二者的物质的量之比为2:3,根据V=nVm知,相同条件下其体积之比等于物质的量之比=2:3,故答案为:1:1;17:18;3:2;2:3.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确物质的量公式中各个物理量关系是解本题关键,题目难度不大.

练习册系列答案
相关题目
18. 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
(1)D的离子结构示意图是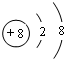 ;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为
;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为 .
.
(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+.
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O.
(4)将一定质量的Mg和D的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则固体混合物中Mg的质量为3.6g;原稀硫酸溶液的物质的量浓度为1mol/L.
 有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:
有A、B、C、D、E、F六种短周期元素,其元素特征信息如下表:| 元素编号 | 元素特征信息 |
| A | A的单质是密度最小的物质 |
| B | B的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| C | C的原子最外层电子数是其内层电子数的三倍 |
| D | D与B同周期,该周期中D的简单离子半径最小 |
| E | B、C、E组成的36电子的化合物Y是家用消毒剂的主要成分 |
| F | F元素最高正价与最低负价的代数和为4 |
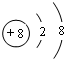 ;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为
;化合物Y所含的化学键名称离子键、共价键;B2C2的电子式表示为 .
.(2)D、E、F的简单离子半径由大到小的顺序是(用化学式表示)S2->Cl->Al3+.
(3)写出两种均含A、B、C、F四种元素的化合物在溶液中相互反应的离子方程式H++HSO3-=SO2↑+H2O.
(4)将一定质量的Mg和D的混合物投入500mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则固体混合物中Mg的质量为3.6g;原稀硫酸溶液的物质的量浓度为1mol/L.
15.两个密闭容器:甲(定TV),乙(定TP),在甲、乙中各通入2molSO2和1mol O2,在相同的温度下达到如下平衡:2SO2(g)+O2(g)?2SO3(g),对此反应,下述说法不正确的是( )
| A. | 反应速率:乙>甲 | B. | SO2的转化率:乙>甲 | ||
| C. | 平衡时各组分含量:乙=甲 | D. | 平衡时容器的压强:乙>甲 |
2.已知向NaNO2溶液中加入酸性KMnO4溶液发生如下反应:2KMnO4+5NaNO2+3H2SO4═2MnSO4+5NaNO3+3H2O+K2SO4有关该反应说法正确的是( )
| A. | 该反应属于复分解反应 | B. | S元素化合价升高 | ||
| C. | N元素被还原 | D. | KMnO4 作氧化剂 |
19.下列说法正确的是( )
| A. | 相对分子质量越大的分子组成的物质,其熔沸点越高 | |
| B. | 在相同物质的量的情况下,多元酸溶液的酸性都比一元酸溶液强 | |
| C. | 在复分解反应中弱酸也可以生成强酸 | |
| D. | 同一元素,价态越高,氧化性肯定越强 |