��Ŀ����
ȼú����������SO2����������������NOx�������ǻ�����ѧ�о����ȵ㣮�±��г���Ŀǰ��ѧ�����������о���3��ȼú������������������������ԭ����
| ������ | ����͵���������֮����ת�����Ͻ��е�������������� |
| ������ | ����ϩ��Ϊ��ԭ�������������ﻹԭΪN2���������� |
| ������ | �õ绯ѧԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ��H2SO4�������� |
NO2��g��+SO2��g��+H2O��l��=H2SO4��l��+NO��g����H1
NO��g��+NO2��g��=N2O3��g����H2
N2O3��g��+2H2SO4��l��=2NOHSO4��s��+H2O��l����H3
4NOHSO4��s��+O2��g��+2H2O��l��=4H2SO4��l��+4NO2��g����H4
2SO2��g��+O2��g��+2H2O��l��=2H2SO4��l����H5
���H1����H2����H3����H4����H5֮��Ĺ�ϵΪ��H5=______��
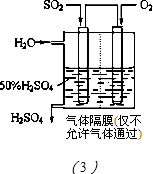
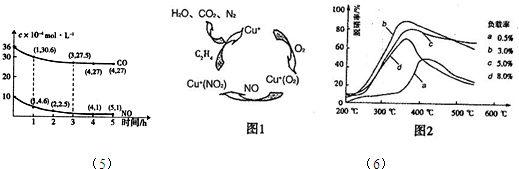
��2�������������������ͼ1�����������¶ȡ������ʣ�����ɸ�д����������������Ĺ�ϵ��ͼ2��ʾ��
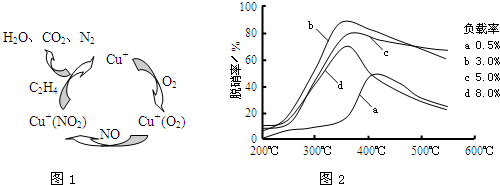
�ٳ���������������ϩ��NO2��Ӧ�Ļ�ѧ����ʽ��______��
�ڴﵽ�������Ч����Ӧ��ȡ��������______��
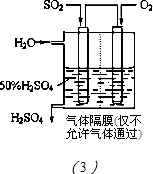
��3�����������õ绯ѧԭ����SO2ת��Ϊ��Ҫ�Ļ���ԭ��H2SO4��װ����ͼ��3����ʾ��
��д��ͨ��SO2�ĵ缫�ĵ缫��Ӧʽ��______��
��Ϊʹ����������ȶ��������У�������Һ��Ũ��Ӧά�ֲ��䣬��ͨ���O2�ͼ����H2O��������Ϊ______��
�⣺��1����֪����NO2��g��+SO2��g��+H2O��l��=H2SO4��l��+NO��g����H1
��NO��g��+NO2��g��=N2O3��g����H2
��N2O3��g��+2H2SO4��l��=2NOHSO4��s��+H2O��l����H3
��4NOHSO4��s��+O2��g��+2H2O��l��=4H2SO4��l��+4NO2��g����H4
���ø�˹���ɽ��١�2+�ڡ�2+�ۡ�2+�ܿɵã�2SO2��g��+O2��g��+2H2O��l��=2H2SO4��l��
���H5=2��H1+2��H2+2��H3+��H4��
�ʴ�Ϊ��2��H1+2��H2+2��H3+��H4��
��2��������ͼ1��֪��C2H4��NO2��Ӧ����CO2��N2��H2O����Ӧ�ķ���ʽΪ2C2H4+6NO2=4CO2+3N2+4H2O��
�ʴ�Ϊ��2C2H4+6NO2=4CO2+3N2+4H2O��
����ͼ2��֪����������ߵ�����Ϊb����ʱ������Ϊ3%����ߵ�Ϊ�¶�Ϊ350�棨��340�桫360�棩��
�ʴ�Ϊ��350�棨��340�桫360�棩��������3%��
��3����ͨ��SO2�ĵ缫Ϊԭ��صĸ���������������Ӧ������SO42-���缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��ԭ����ܷ�ӦΪ2SO2+2H2O+O2=2H2SO4����ͨ��1molO2��ymolˮ��������2molH2SO4������2molˮ��2molSO2����������Ũ�Ȳ��䣬
���У�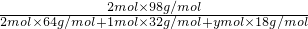 ��100%=50%����֮��18y=232��
��100%=50%����֮��18y=232��
������1molO2����32g����Ҫ232gˮ������ʹ����Ũ�Ȳ��䣬��m��O2����m��H2O��=32��232=4��29��
�ʴ�Ϊ��4��29��
��������1�����ø�˹���ɼ��㷴Ӧ�ȣ�
��2���ٸ��ݷ�Ӧ����������������غ㶨����д��ѧ����ʽ��
�ڸ���ͼ���ж���������ʵ��¶Ⱥ����ʣ�
��3����ͨ��SO2�ĵ缫Ϊԭ��صĸ���������������Ӧ��
�ڸ���ԭ����ܷ�Ӧ2SO2+2H2O+O2=2H2SO4�������Ũ�Ȳ�����㣮
���������⿼������������Ⱦ���������Ȼ�ѧ����ʽ�Լ�ԭ���֪ʶ����Ŀ�ۺ϶Ƚϸߣ��Ѷ��еȣ����ʱע��������������Ϣ�������ǣ�3���⣬ע��ӻ�ѧ����ʽ�ĽǶȽ��
��NO��g��+NO2��g��=N2O3��g����H2
��N2O3��g��+2H2SO4��l��=2NOHSO4��s��+H2O��l����H3
��4NOHSO4��s��+O2��g��+2H2O��l��=4H2SO4��l��+4NO2��g����H4
���ø�˹���ɽ��١�2+�ڡ�2+�ۡ�2+�ܿɵã�2SO2��g��+O2��g��+2H2O��l��=2H2SO4��l��
���H5=2��H1+2��H2+2��H3+��H4��
�ʴ�Ϊ��2��H1+2��H2+2��H3+��H4��
��2��������ͼ1��֪��C2H4��NO2��Ӧ����CO2��N2��H2O����Ӧ�ķ���ʽΪ2C2H4+6NO2=4CO2+3N2+4H2O��
�ʴ�Ϊ��2C2H4+6NO2=4CO2+3N2+4H2O��
����ͼ2��֪����������ߵ�����Ϊb����ʱ������Ϊ3%����ߵ�Ϊ�¶�Ϊ350�棨��340�桫360�棩��
�ʴ�Ϊ��350�棨��340�桫360�棩��������3%��
��3����ͨ��SO2�ĵ缫Ϊԭ��صĸ���������������Ӧ������SO42-���缫��ӦʽΪSO2+2H2O-2e-=SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-=SO42-+4H+��
��ԭ����ܷ�ӦΪ2SO2+2H2O+O2=2H2SO4����ͨ��1molO2��ymolˮ��������2molH2SO4������2molˮ��2molSO2����������Ũ�Ȳ��䣬
����
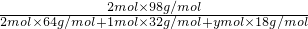 ��100%=50%����֮��18y=232��
��100%=50%����֮��18y=232��������1molO2����32g����Ҫ232gˮ������ʹ����Ũ�Ȳ��䣬��m��O2����m��H2O��=32��232=4��29��
�ʴ�Ϊ��4��29��
��������1�����ø�˹���ɼ��㷴Ӧ�ȣ�
��2���ٸ��ݷ�Ӧ����������������غ㶨����д��ѧ����ʽ��
�ڸ���ͼ���ж���������ʵ��¶Ⱥ����ʣ�
��3����ͨ��SO2�ĵ缫Ϊԭ��صĸ���������������Ӧ��
�ڸ���ԭ����ܷ�Ӧ2SO2+2H2O+O2=2H2SO4�������Ũ�Ȳ�����㣮
���������⿼������������Ⱦ���������Ȼ�ѧ����ʽ�Լ�ԭ���֪ʶ����Ŀ�ۺ϶Ƚϸߣ��Ѷ��еȣ����ʱע��������������Ϣ�������ǣ�3���⣬ע��ӻ�ѧ����ʽ�ĽǶȽ��

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ

 7N2��12H2O
7N2��12H2O  O��O2 ��NO��O3��NO2��O2 ��NO2��O��NO��O2
O��O2 ��NO��O3��NO2��O2 ��NO2��O��NO��O2 