题目内容
7.配平下列化学方程式:4CuFeS2+2H2SO4+17O2═4CuSO4+2Fe2(SO4)3+2H2O.
分析 根据元素化合价的变化:铁元素化合价从+2升高到了+3价,硫元素的化合价从-2价升高到了+6价,氧元素的化合价从0降到了-2价,根据电子守恒配平结合元素守恒方程式即可.
解答 解:根据Fe元素守恒,在CuFeS2前边乘以2,铁元素化合价从+2升高到了+3价,2个铁原子总共升高了2价,硫元素的化合价从-2价升高到了+6价,S总共升高了32价,氧元素的化合价从0降到了-2价,根据电子守恒,所以O2前边系数是17,CuFeS2前边系数是4,根据Cu元素守恒,所以CuSO4前边系数是4,Fe2(SO4)3的前边系数是2,最后根据H、S元素守恒,得到硫酸的系数是2,水的系数是2,即4CuFeS2+2H2SO4+17O2═4CuSO4+2Fe2(SO4)3+2H2O.
故答案为:4;2;17;4;2;2.
点评 本题考查学生电子守恒法配平氧化还原反应,注意化合价升降和电子守恒的关系是关键,难度中等.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
17.下列过程属于化学变化的是( )
| A. | 焰色反应 | B. | 石油分馏 | C. | 塑料老化 | D. | 活性炭吸附 |
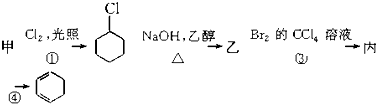
18.用有机物甲可制备环己二烯( ),其反应路线如图所示,下列有关判断正确的是( )
),其反应路线如图所示,下列有关判断正确的是( )
 ),其反应路线如图所示,下列有关判断正确的是( )
),其反应路线如图所示,下列有关判断正确的是( )
| A. | 甲的化学名称是苯 | |
| B. | 乙的结构简式为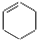 | |
| C. | 反应①为加成反应 | |
| D. | 有机物丙既能发生加成反应,又能发生取代反应 |
15.下列各组物质中,互为同分异构体的是( )
| A. | 果糖 葡萄糖 | B. | 蔗糖 葡萄糖 | C. | 淀粉 纤维素 | D. | 乙酸 乙醇 |
2.某同学在常温下设计以下实验流程探究Na2S203的化学性质.
pH=8$\stackrel{①}{\underset{\;←}{pH试纸}}$Na2S2O3溶液$→_{同时加过量BaCl_{2}溶液}^{②加入足量氯水}$白色沉淀B.
下列说法正确的是( )
pH=8$\stackrel{①}{\underset{\;←}{pH试纸}}$Na2S2O3溶液$→_{同时加过量BaCl_{2}溶液}^{②加入足量氯水}$白色沉淀B.
下列说法正确的是( )
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=10-8mol/L | |
| B. | Na2S2O3溶液PH=8的原因用离子方程式表示为S2O32-+2H2O═H2S2O3+2OH- | |
| C. | 生成的沉淀BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
12.由-C6H5、-C6H4-、-CH2-、-OH四种原子团各一种组成属于酚类的物质的种类有( )
| A. | 3种 | B. | 4种 | C. | 1种 | D. | 2种 |
19.一定温度下,对于反应N2+O2?2NO在密闭容器中进行,下列措施能增大反应速率的是( )
| A. | 缩小体积使压强增大 | B. | 恒容,充入N2 | ||
| C. | 恒容充入氦气 | D. | 恒压充入氦气 |
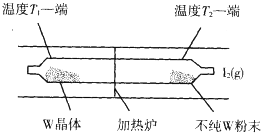 利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0
利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)?WI2(g)△H<0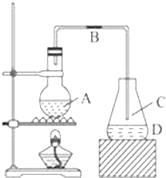 某化学课外小组用如图装置制取溴苯,请按要求完成下列小题:
某化学课外小组用如图装置制取溴苯,请按要求完成下列小题: .
.