题目内容
【题目】某课外小组研究铝土矿中Al2O3的含量。已知铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
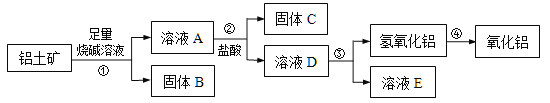
(1)固体B的主要用途有(写出1条即可)________________。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是________________________________;_______________________________________;
第③步中,用足量氨水制氢氧化铝的化学方程式是________________________________。
(3)将实验过程中所得固体精确称量,课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是__________。(保留一位小数)
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性,该反应的化学方程式是_____________________________。
【答案】 炼铁原料、用作涂料、油漆等 Al2O3+2OH-= 2AlO2-+H2O SiO2+2OH-= SiO32-+ H2O AlCl3 +3NH3·H2O = Al(OH)3↓+ 3NH4Cl 65.4% Al2O3+3Cl2+3C![]() 2AlCl3 +3CO
2AlCl3 +3CO
【解析】试题铝土矿中Al2O3与氢氧化钠反应生成偏铝酸钠、SiO2与氢氧化钠反应生成硅酸钠,所以溶液A中含有偏铝酸钠、硅酸钠,只有Fe2O3难溶于氢氧化钠溶液,所以固体B是Fe2O3;偏铝酸钠与足量盐酸反应生成氯化铝,硅酸钠与盐酸反应生成硅酸沉淀,所以固体C是硅酸、溶液D是氯化铝;氯化铝溶液与足量氨水反应生成氢氧化铝沉淀,氢氧化铝加热生成氧化铝。
解析:根据以上分析,(1)固体B是Fe2O3,用途是炼铁原料、用作涂料、油漆等。(2)向铝土矿中加入足量烧碱溶液后,铝土矿中Al2O3与氢氧化钠反应生成偏铝酸钠、SiO2与氢氧化钠反应生成硅酸钠,发生反应的离子方程式是Al2O3+2OH-= 2AlO2-+H2O 、 SiO2+2OH-= SiO32-+ H2O;第③步中,足量氨水与氯化铝反应制氢氧化铝的化学方程式是AlCl3 +3NH3·H2O = Al(OH)3↓+ 3NH4Cl。(3)根据铝元素守恒,![]() ,该铝土矿中Al2O3的质量分数是
,该铝土矿中Al2O3的质量分数是![]() 65.4%;(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性的CO气体,该反应的化学方程式是Al2O3+3Cl2+3C
65.4%;(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,生成两种化合物,其中一种是还原性气体且有毒性的CO气体,该反应的化学方程式是Al2O3+3Cl2+3C![]() 2AlCl3 +3CO。
2AlCl3 +3CO。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案【题目】工业上,CH3OH也可由CO和H2合成.参考合成反应CO(g)+2H2(g)CH3OH(g)的平衡常数.下列说法正确的是 ( )
温度/℃ | 0 | 100 | 200 | 300 | 400 |
平衡常数 | 667 | 13 | 1.9×10﹣2 | 2.4×10﹣4 | 1×10﹣5 |
A.该反应正反应是放热反应
B.该反应在低温下不能自发进行,高温下可自发进行,说明该反应△S<0
C.在T℃时,1L密闭容器中,投入0.1mol CO和0.2mol H2 , 达到平衡时,CO转化率为50%,则此时的平衡常数为100
D.工业上采用稍高的压强(5MPa)和250℃,是因为此条件下,原料气转化率最高
【题目】实验室可用草酸(H2C2O4)在浓硫酸的作用下分解得一氧化碳,某研究小组利用如图所示装置探究温度对CO还原Fe2O3的影响(固定装置略):

(1)草酸(H2C2O4)在浓硫酸的作用下分解制取一氧化碳的化学方程式为_____________________。
(2)装置C的作用是_______________,加热D装置之前需进行的操作是___________________。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀硫酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①甲组步骤1中反应的化学方程式为_________________________。
②甲组步骤3中,溶液变红的离子方程式为______________________。
③乙组得到的黑色粉末是_____________(填化学式)。
④乙组步骤4中,溶液褪色可能的原因及其验证方法为_______________________。
(4)该装置的改进措施除了在E装置后加尾气处理装置外还需_______________________。
【题目】实验室利用废铜合金(含少量铁和铝)来制取硫酸铜晶体(CuSO4·5H2O),方案如下:

金属离子生成氢氧化物沉淀的pH可参考下列数据:
Fe3+ | Fe2+ | Cu2+ | Al3+ | |
开始沉淀时的pH | 2.2 | 7.5 | 5.2 | 3.7 |
完全沉淀时的pH | 3.2 | 9.0 | 6.7 | 4.7 |
请回答:
(1)若溶解合金时加入的混酸由2 L 3 mol·L-1硫酸和1 L 2 mol·L-1硝酸混合而成,则反应后生成标准状况下的NO的体积最多为____________L。
(2)加入H2O2的目的是____________。
(3)为保证产品的纯度,M物质最好选用________(填字母),调节pH的范围为____________。
a.Cu(OH)2 b.H2SO4 c.NH3·H2O d.Na2CO3
(4)滤液D中加入硫酸的目的为_______________________________________。
(5)从溶液E制得CuSO4·5H2O晶体所需要的步骤为________、结晶、过滤和干燥。
(6)0.80g CuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示。试确定200℃时固体物质的化学式______________。



