题目内容
【题目】二氧化锰不仅是活性好的催化剂,也被广泛用作干电池的正极材料。某化学小组设计用高硫锰矿(主要成分为锰的化合物和硫化亚铁)为原料制取二氧化锰的工艺流程如图:
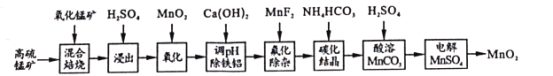
已知:①“混合焙烧”后的烧渣含MnSO4、Fe2O3及少量FeO、MgO、Al2O3
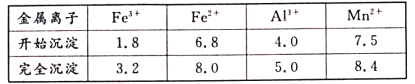
②在该条件下,金属离子开始沉淀和完全沉淀的pH如下表。
(1)写出浸出时与铝元素有关的离子反应方程式__。
(2)上述“氧化”步骤是否可省略__(填“是”或“否”),你的依据是__。
(3)“调pH除铁铝’’时,生成沉淀的pH范围为__;“氟化除杂”中除去的离子为__。
(4)请用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程__(用文字和离子方程式表达)。
(5)用惰性电极电解MnSO4制备MnO2时,其阳极反应式为__;整个流程中能够循环利用的物质除MnO2外还有__(写名称)。
【答案】Al2O3+6H+=2Al3++3H2O 否 若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会部分被沉淀下来造成损失 5.0≤pH<7.5 Ca2+、Mg2+ 加入NH4HCO3后,Mn2+与HCO![]() 电离出的CO
电离出的CO![]() 生成MnCO3,HCO
生成MnCO3,HCO![]()
![]() CO
CO![]() +H+、Mn2++CO
+H+、Mn2++CO![]()
![]() MnCO3,HCO
MnCO3,HCO![]() 电离出H+与另一部分HCO
电离出H+与另一部分HCO![]() 反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀 Mn2+-2e-+2H2O=MnO2+4H+ 硫酸
反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀 Mn2+-2e-+2H2O=MnO2+4H+ 硫酸
【解析】
高硫锰矿(主要成分为含锰化合物及FeS)与氧化锰矿混合焙烧,得到MnSO4、Fe2O3及少量FeO、Al2O3、MgO,加入硫酸,得到Mn2+、Fe2+、Fe3+、Mg2+、Al3+的酸性溶液,加入二氧化锰将亚铁离子氧化为铁离子便于除去,再加入氢氧化钙中和,将铁离子与铝离子以氢氧化物的形式除去,加入MnF2除杂,使溶液中的Ca2+、Mg2+沉淀完全,此时溶液中的金属离子为锰离子,加入碳酸氢铵发生Mn2++2HCO3-=MnCO3↓+CO2↑+H2O,加入硫酸溶解MnCO3得到MnSO4溶液,电解MnSO4溶液得到MnO2和硫酸,硫酸和MnO2可循环利用。
(1)浸出时与铝元素有关的离子反应,氧化铝溶于酸生成铝盐和水,离子方程式为Al2O3+6H+=2Al3++3H2O。故答案为:Al2O3+6H+=2Al3++3H2O;
(2)上述“氧化”步骤不可以省略,依据是若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会部分被沉淀下来造成损失。故答案为:否;若不进行氧化,则Fe2+被完全沉淀的pH为8.0,此时Mn2+也会部分被沉淀下来造成损失;
(3)“调pH除铁铝’’时,让铝沉淀完全时pH=5,而锰不沉淀时pH小于7.5,生成沉淀的pH范围为5.0≤pH<7.5;CaF2、MgF2难溶于水,“氟化除杂”中除去的离子为Ca2+、Mg2+。故答案为:5.0≤pH<7.5;Ca2+、Mg2+;
(4)用平衡移动原理解释除杂处理后的Mn2+用NH4HCO3转化成MnCO3沉淀的过程:加入NH4HCO3后,Mn2+与HCO![]() 电离出的CO
电离出的CO![]() 生成MnCO3,HCO
生成MnCO3,HCO![]()
![]() CO
CO![]() +H+、Mn2++CO
+H+、Mn2++CO![]()
![]() MnCO3,HCO
MnCO3,HCO![]() 电离出H+与另一部分HCO
电离出H+与另一部分HCO![]() 反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀。故答案为:加入NH4HCO3后,Mn2+与HCO
反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀。故答案为:加入NH4HCO3后,Mn2+与HCO![]() 电离出的CO
电离出的CO![]() 生成MnCO3,HCO
生成MnCO3,HCO![]()
![]() CO
CO![]() +H+、Mn2++CO
+H+、Mn2++CO![]()
![]() MnCO3,HCO
MnCO3,HCO![]() 电离出H+与另一部分HCO
电离出H+与另一部分HCO![]() 反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀;
反应生成H2O和CO2,促进上述两个平衡正向移动,从而生成MnCO3沉淀;
(5)用惰性电极电解MnSO4制备MnO2时,电解过程中阳极发生氧化反应,元素化合价升高,故为硫酸锰失去电子生成二氧化锰和硫酸,其阳极反应式为Mn2+-2e-+2H2O=MnO2+4H+;整个流程中能够循环利用的物质除MnO2外还有硫酸。故答案为:Mn2+-2e-+2H2O=MnO2+4H+;硫酸。

【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300℃以上完全分解; ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险; ④受热或遇水分解放热,放出腐蚀性烟气; | ||||
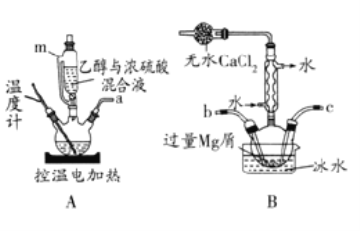
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品。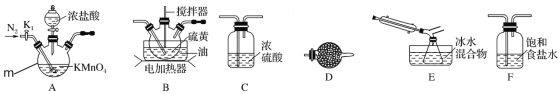
①仪器m的名称为___,装置F中试剂的作用是___。
②装置连接顺序:A→___→E→D。
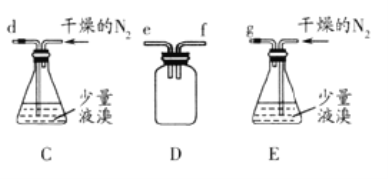
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是___。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和___。
(2)①S2Cl2遇水强烈反应产生烟雾,其产物中有一种气体X能使品红溶液褪色,加热后又恢复原状,且反应过程中只有一种元素化合价发生变化,写出该反应的化学方程式___。
②甲同学为了验证两种气体产物,将水解生成的气体依次通过硝酸银与稀硝酸的混合溶液、品红溶液、NaOH 溶液,该方案___(填“可行”或“不可行”),原因是___。
(3)某同学为了测定S2Cl2与水反应后生成的气体X在混合气体中的体积分数,设计了如下实验方案:
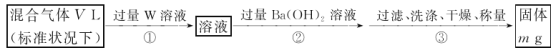
①W溶液可以是___(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中气体X的体积分数为____(用含V、m的式子表示)。
【题目】某研究性学习小组向一定量的NaHSO3溶液(加入少量淀粉)中加入稍过量的KIO3 溶液,一段时![]() 间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
间后,溶液突然变蓝色。为进一步研究有关因素对反应速率的影响,探究如下。
(1)查阅资料 知NaHSO3与过量KIO3反应分为两步进行,且其反应速率主要由第一步反应决定。已知第一步反应的离子方程式为IO3—+3HSO3—===3SO42—+I—+3H+,则第二步反应的离子方程式为________________。
(2)通过测定溶液变蓝所用时间来探究外界条件对该反应速率的影响,记录如下。
编号 | 0.01mol/LNaHSO3溶液/mL | 0.01mol/L KIO3 溶液/mL | H2O/mL | 反应温度 /℃ | 溶液变蓝所用时间t/s |
① | 6.0 | 10.0 | 4.0 | 15 | t1 |
② | 6.0 | 14.0 | 0 | 15 | t2 |
③ | 6.0 | a | b | 25 | t3 |
实验①②是探究_______________对反应速率的影响,表中t1___________t2(填“>”、“=”或“<”);
实验①③是探究温度对反应速率的影响,表中a=_____________,b=_____________。、
(3)将NaHSO3溶液与KIO3溶液在恒温条件下混合,用速率检测仪检测出起始阶段反应速率 逐渐增大。该小组对其原因提出如下假设,请你完成假设二。
假设一:生成的SO42—对反应起催化作用;
假设二:___________________________;……
(4)请你设计实验验证上述假设一,完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
在烧杯甲中将一定量的NaHSO3溶液与KIO3溶液混合,用速率检测仪测定起始时的反应速率v(甲) 在烧杯乙中先加入少量①_____,其他条件与甲完全相同,用速率检测仪测定起始时的反应速率v(乙) | ②若v(甲)___v(乙),则假设一不成立 ③若v(甲)___v(乙),则假设一成立 (填“>”、“=”或“<”) |