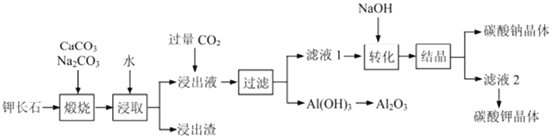
题目内容
【题目】用化学知识填空:
(1)丙烷通过脱氢反应可得丙烯。
已知:①C3H8(g)===CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol-1
②C3H6(g)===CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol-1
则相同条件下,反应C3H8(g)===C3H6(g)+H2(g)的ΔH=__________kJ·mol-1。
(2)0.5mol甲烷燃烧时,生成液态水和二氧化碳,同时放出445kJ的热量,写出甲烷的燃烧热的热化学方程式_________________________________________________
(3)请写出NH4Cl溶液中各离子浓度的大小关系式:___________________________________
(4)常温下,Na2CO3溶液呈碱性,原因是_____________________ (用离子方程式表示)。
(5)①醋酸在水溶液中的电离方程式为______________________。
②下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
a. 滴加少量浓盐酸 b. 微热溶液 c. 加水稀释 d. 加入少量醋酸钠晶体
【答案】 +124.2 kJ·mol-1 CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1 c(Cl-)>c(NH![]() )>c(H+)>c(OH-) CO32-+H2O
)>c(H+)>c(OH-) CO32-+H2O![]() HCO3-+OH- CH3COOH
HCO3-+OH- CH3COOH![]() CH3COO-+H+ bc
CH3COO-+H+ bc
【解析】(1)本题考查热化学反应方程式的计算,①-②得出△H=△H1-△H2=(156.6-32.4)kJ·mol-1=+124.2kJ·mol-1;(2)本题考查热化学反应方程式的书写,根据燃烧热的定义,1mol甲烷燃烧产生的热量为1×445/0.5kJ=890kJ,即甲烷燃烧热的热化学反应方程式为:CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1;(3)本题考查离子浓度大小比较,NH4Cl溶液中存在:NH4++H2O ![]() NH3·H2O+H+,NH4+水解程度微弱,因此离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-);(4)本题考查盐类水解应用,Na2CO3溶液中CO32-发生水解,其水解反应方程式为CO32-+H2O
NH3·H2O+H+,NH4+水解程度微弱,因此离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-);(4)本题考查盐类水解应用,Na2CO3溶液中CO32-发生水解,其水解反应方程式为CO32-+H2O![]() HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O![]() H2CO3+OH-,使溶液中c(OH-)>c(H+),溶液显碱性;(5)考查弱电解质的电离以及影响弱电解质电离的因素,①CH3COOH属于弱电解质,醋酸部分电离,其电离方程式为CH3COOH
H2CO3+OH-,使溶液中c(OH-)>c(H+),溶液显碱性;(5)考查弱电解质的电离以及影响弱电解质电离的因素,①CH3COOH属于弱电解质,醋酸部分电离,其电离方程式为CH3COOH![]() CH3COO-+H+;②a、滴加少量浓盐酸,c(H+)增大,抑制CH3COOH的电离,故a错误;b、弱电解质的电离是吸热过程,升高温度,促进电离,即CH3COOH的电离程度增大,故b正确;c、加水稀释,促进电离,即CH3COOH的电离程度增大,故c正确;d、加入醋酸钠晶体,CH3COOH的电离程度降低,故d错误。
CH3COO-+H+;②a、滴加少量浓盐酸,c(H+)增大,抑制CH3COOH的电离,故a错误;b、弱电解质的电离是吸热过程,升高温度,促进电离,即CH3COOH的电离程度增大,故b正确;c、加水稀释,促进电离,即CH3COOH的电离程度增大,故c正确;d、加入醋酸钠晶体,CH3COOH的电离程度降低,故d错误。

 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
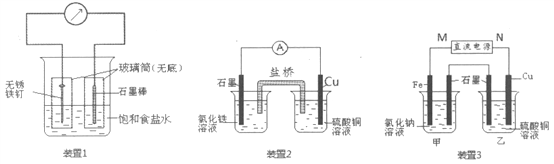
金状元绩优好卷系列答案【题目】下列说法中,不正确的是
A | B | C | D |
|
|
|
|
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸性较强,发生析氢腐蚀 | 将锌板换成铜板对钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
A. A B. B C. C D. D